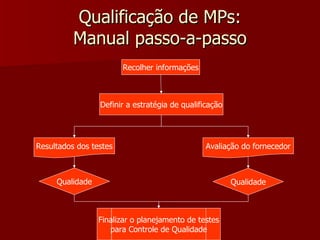
O documento discute a qualificação de matérias-primas, incluindo os benefícios de um sistema de qualidade, os custos da falta de qualidade, os elementos básicos de um sistema de qualidade e as normas legais relacionadas. Ele também fornece considerações sobre a qualificação de matérias-primas e lista procedimentos-chave para um programa de qualificação de matérias-primas.