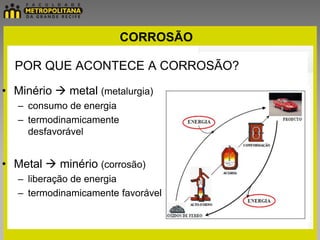
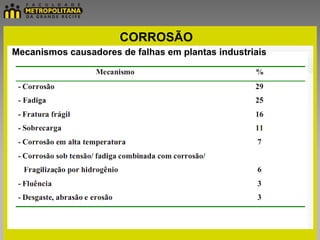
O documento discute eletroquímica e corrosão. Apresenta conceitos básicos de eletroquímica como pilhas, eletrólise e potenciais de eletrodo. Também define corrosão e descreve seus principais mecanismos e meios de proteção como pinturas, revestimentos metálicos e galvanização.