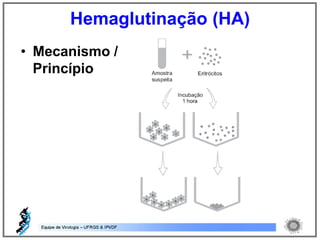
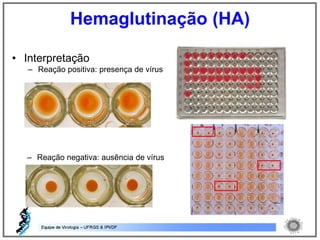
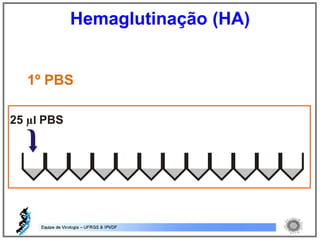
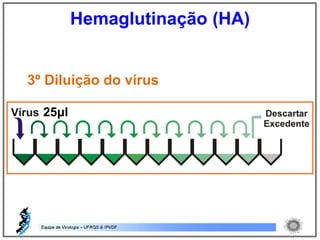
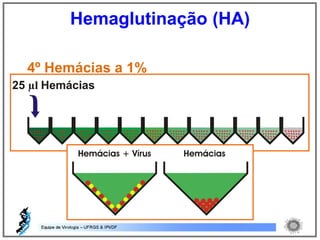
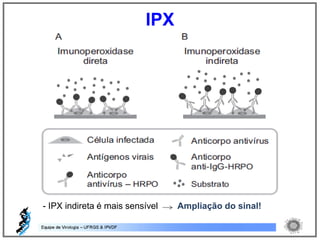
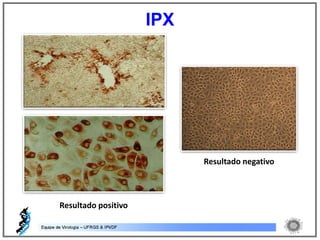
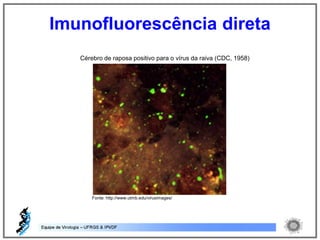
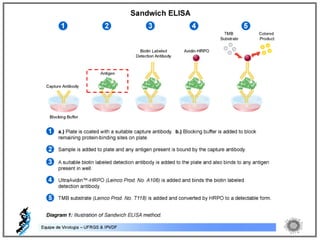
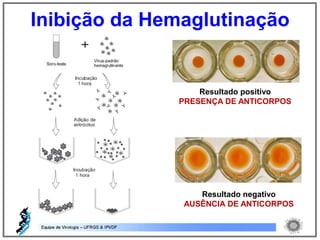
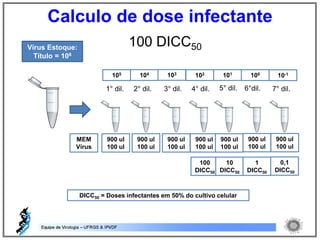
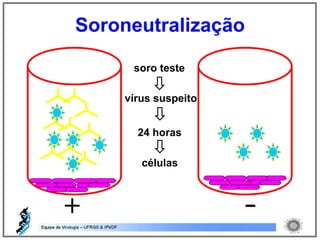
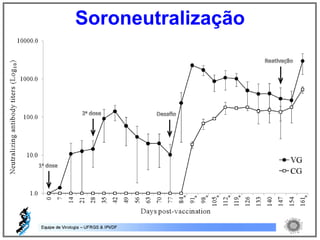
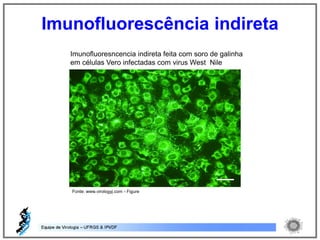
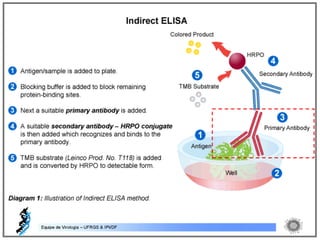
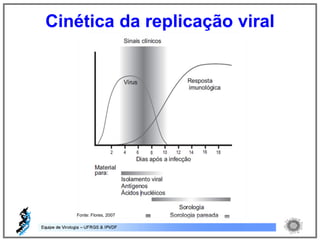
O documento resume os principais métodos de diagnóstico de infecções virais, incluindo métodos diretos como microscopia eletrônica, isolamento viral e detecção de ácidos nucleicos, e métodos indiretos como detecção de anticorpos por soroneutralização, inibição da hemaglutinação e ELISA indireto.