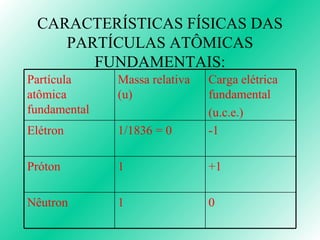
Este documento descreve a evolução dos modelos atômicos ao longo da história, começando com os filósofos gregos que propuseram a ideia de átomo como partícula indivisível da matéria. Posteriormente, Dalton, Thomson e Rutherford desenvolveram modelos atômicos com base em novas descobertas, e Chadwick descobriu o nêutron. Atualmente, o modelo atômico clássico representa o átomo como um núcleo cercado por elétrons.