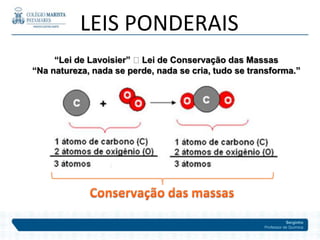
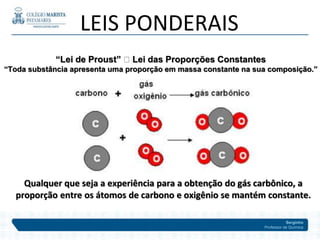
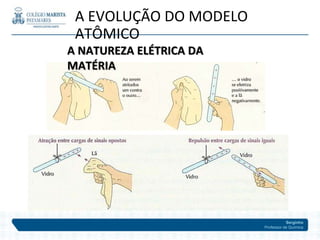
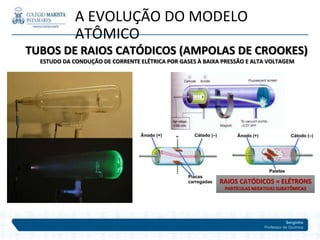
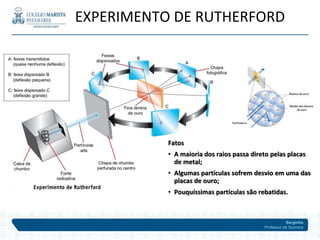
O documento descreve a evolução dos modelos atômicos ao longo do tempo, começando pelos primeiros modelos de Leucipo e Demócrito no século V a.C. até o modelo planetário de Rutherford em 1911. Inclui também detalhes sobre as partículas subatômicas como prótons, nêutrons e elétrons, além de conceitos como número atômico, número de massa e isótopos.