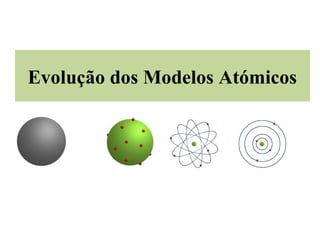
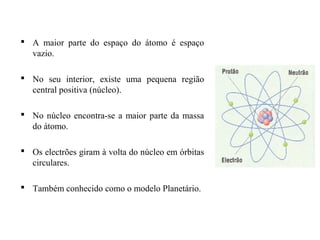
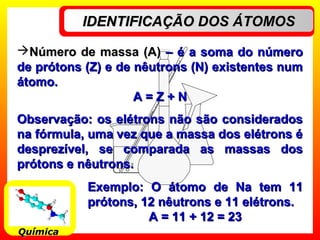
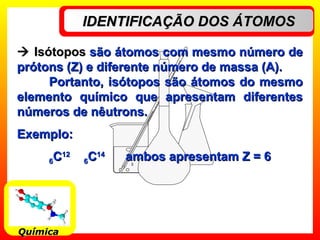
O documento descreve a evolução dos modelos atômicos, começando pelo modelo de Dalton, passando pelo modelo de Thomson e Rutherford, até chegar no modelo de Bohr. Os principais pontos apresentados são que o átomo não é indivisível, possui um núcleo central onde está a maior parte da massa, e os elétrons giram em órbitas definidas em torno do núcleo.