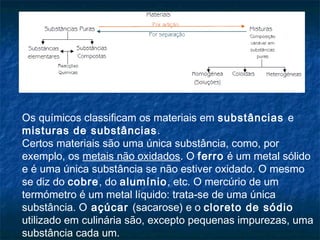
O documento discute a diversidade de materiais, sua classificação e constituição. Materiais podem ser naturais ou sintéticos e são classificados como substâncias puras ou misturas. Misturas podem ser homogêneas, heterogêneas ou coloidais dependendo de sua aparência e estrutura a nível microscópico. A constituição dos materiais envolve átomos, moléculas ou íons.