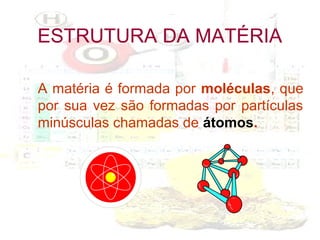
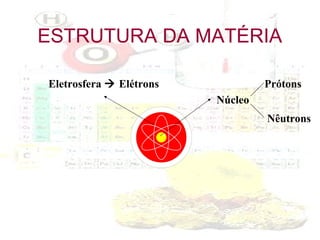
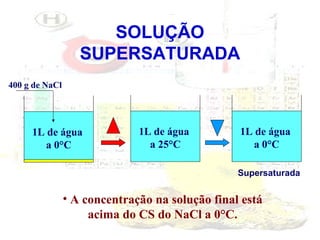
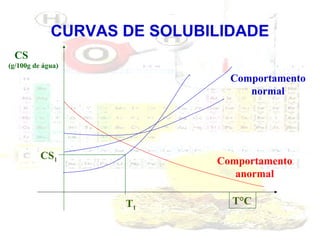
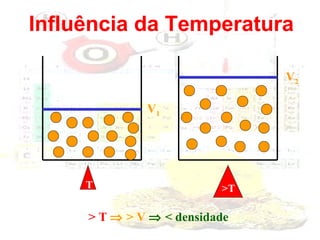
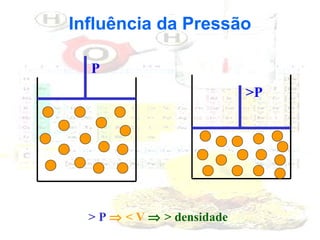
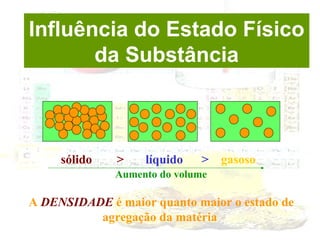
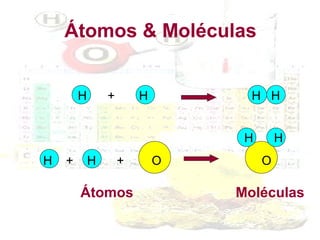
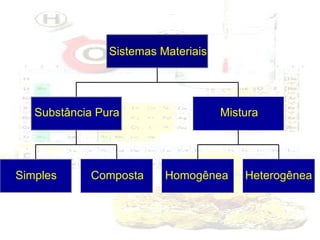
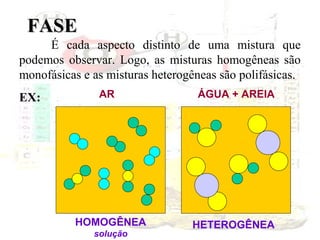
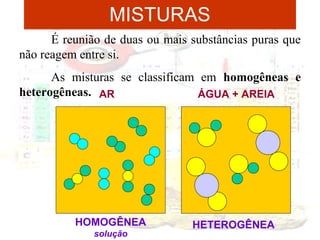
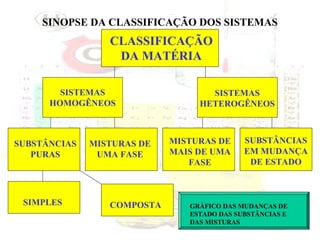
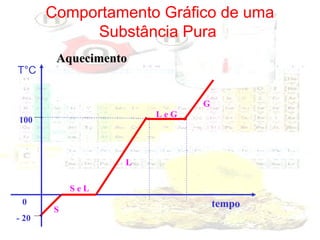
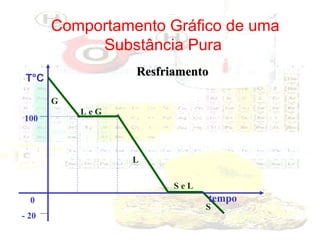
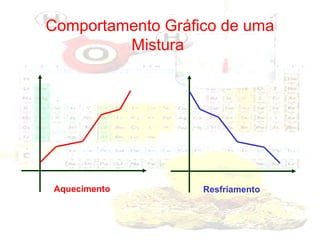
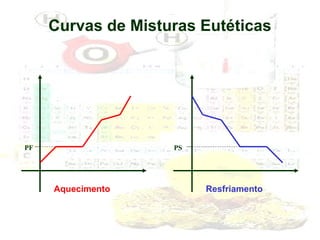
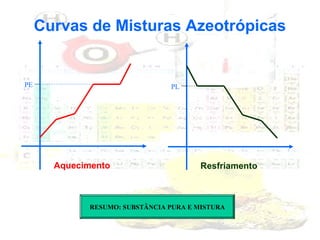
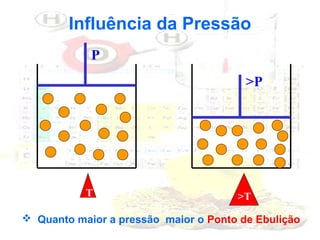
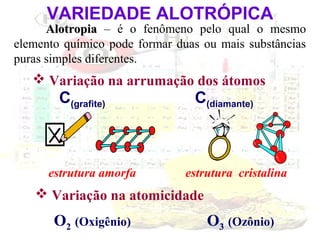
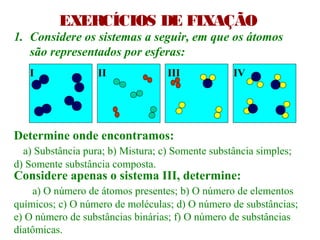
1) O documento introduz os conceitos básicos da química, incluindo a importância do estudo da química e uma breve história da química, desde os primeiros experimentos no Egito Antigo até o desenvolvimento da química como ciência moderna.
2) A breve história da química descreve os principais pensadores e suas contribuições, como Empédocles e sua teoria dos quatro elementos, e como a química evoluiu da alquimia para se tornar uma ciência experimental no século XVII.