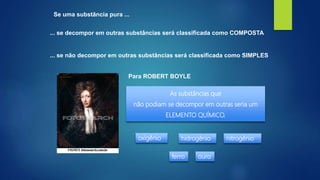
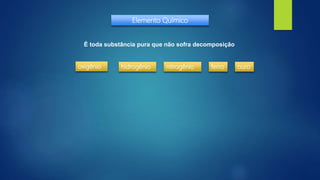
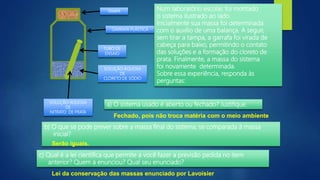
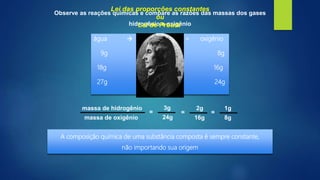
[1] O documento discute vários processos de separação de misturas, incluindo evaporação, cristalização, destilação, decantação, centrifugação, peneiração e flotação.
[2] A maioria das substâncias na natureza são encontradas como misturas e os químicos precisam isolar seus componentes de forma pura usando processos apropriados dependendo do tipo de mistura e das condições econômicas.
[3] Processos como filtração, destilação e dissolução fracionada podem ser usados para separar