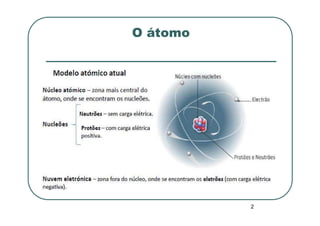
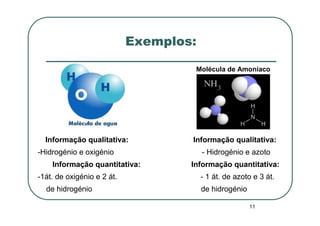
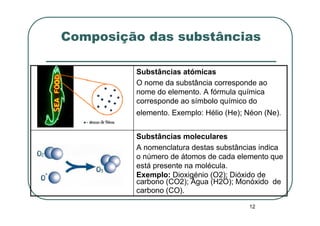
Este documento discute os elementos químicos e a tabela periódica. Explica como os átomos são caracterizados e como a massa atômica relativa é determinada levando em conta os isótopos e suas abundâncias. Também descreve como a tabela periódica organiza os elementos e como as fórmulas químicas fornecem informações qualitativas e quantitativas sobre a composição das substâncias atômicas, moleculares e iônicas.