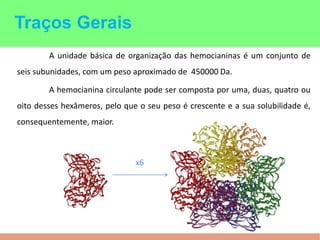
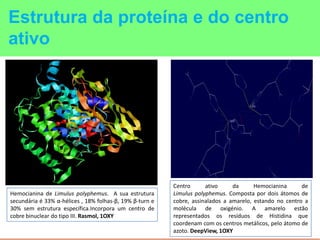
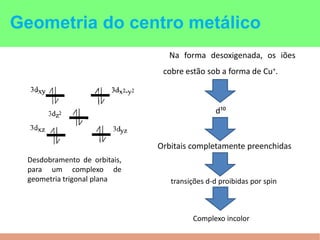
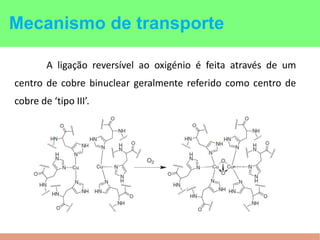
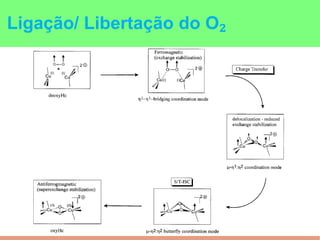
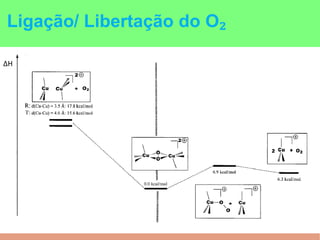
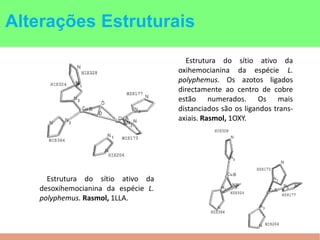
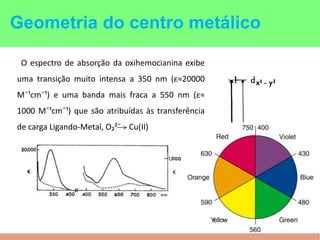
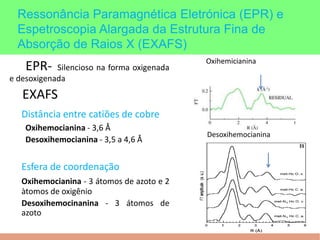
This document summarizes the key points of hemocyanin, an oxygen-transport metalloprotein found in some arthropods and mollusks. It contains two copper atoms that reversibly bind to oxygen. The deoxygenated form is colorless and the oxygenated form is blue. It has been crystallized from various species and its basic structural unit is a hexamer of subunits.