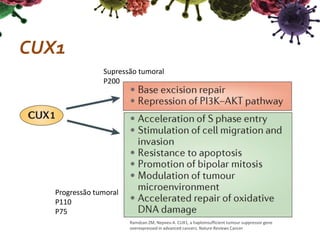
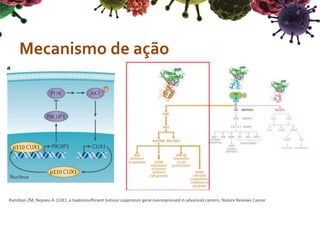
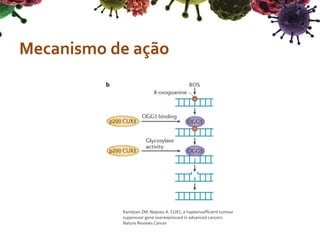
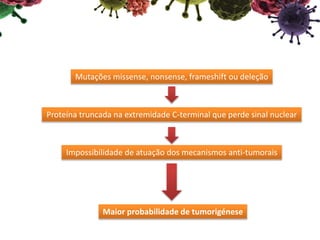
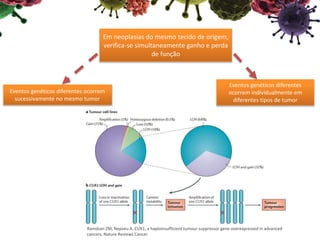
O documento descreve o gene CUX1, que codifica três proteínas (p200, p110 e p75) e atua como um gene supressor de tumor e oncogene. Níveis reduzidos de CUX1 promovem o desenvolvimento do tumor inicial, enquanto um aumento nos níveis de CUX1 promove a progressão do tumor avançado através de mecanismos diferentes. O documento analisa o papel dual deste gene na tumorigênese.