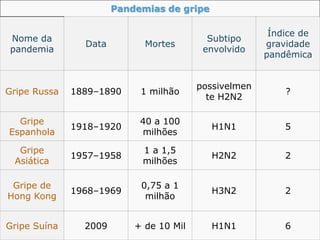
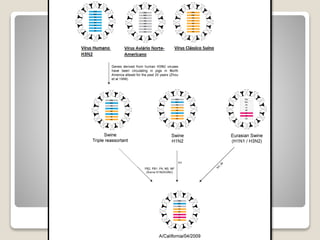
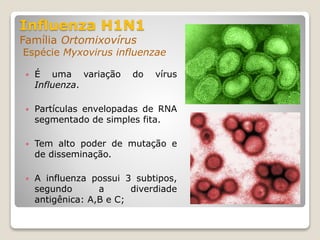
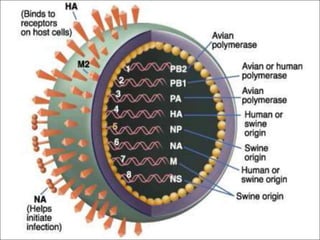
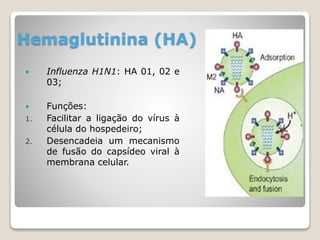
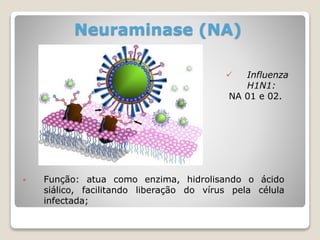
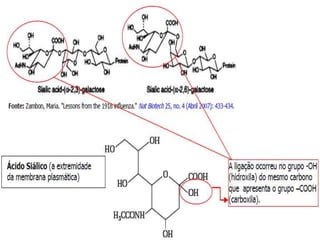
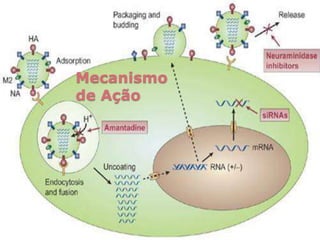
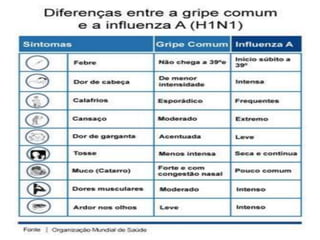
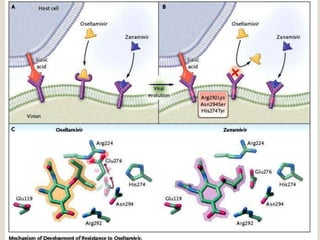
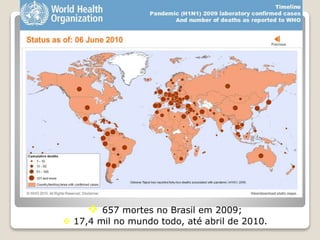
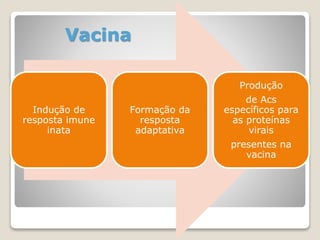
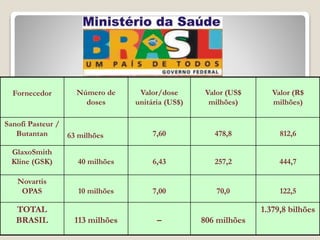
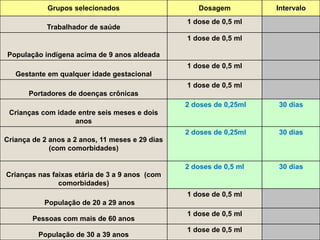
O documento discute a pandemia de H1N1 de 2009, definindo endemia, epidemia e pandemia. Descreve as principais pandemias de gripe do passado e detalha as características virológicas do vírus H1N1, incluindo sua estrutura, genes e mecanismo de mutação. Também aborda o diagnóstico, tratamento, vacina e aspectos epidemiológicos da pandemia de 2009.