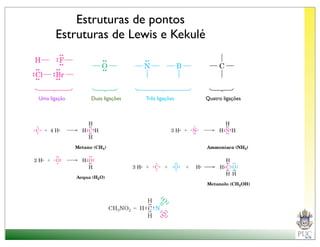
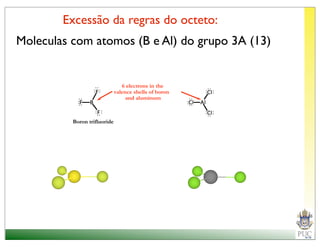
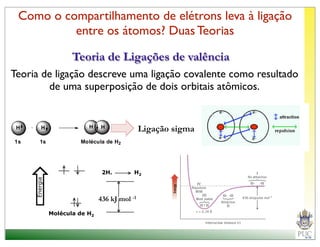
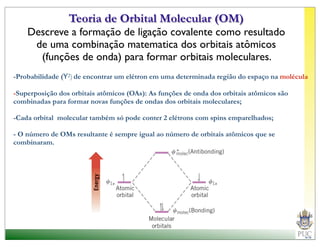
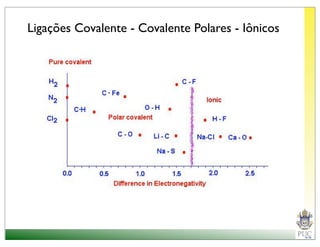
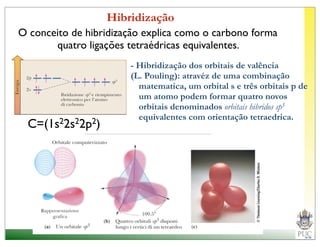
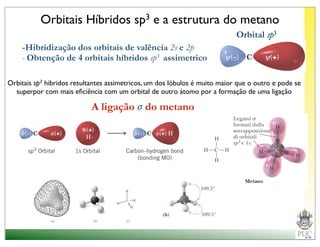
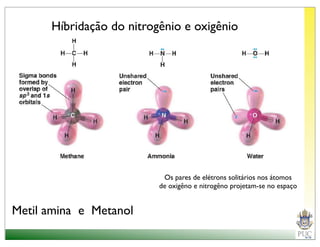
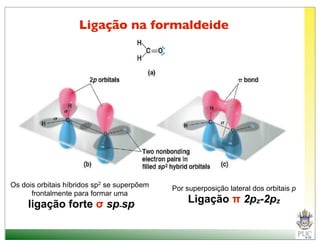
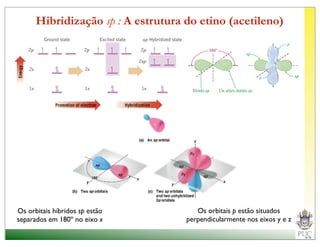
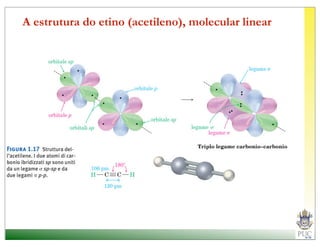
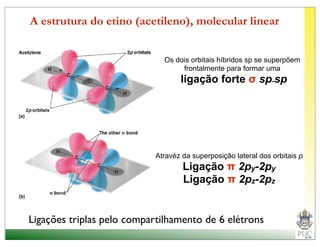
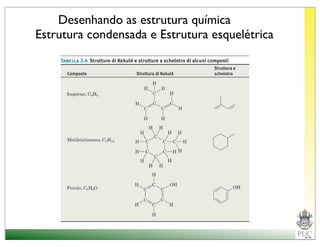
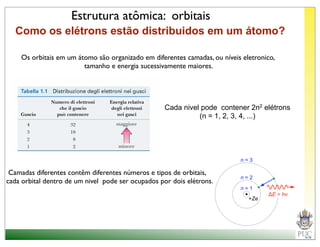
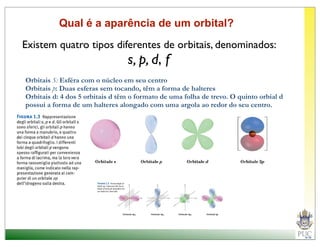
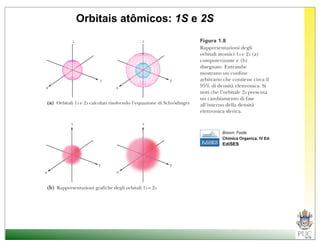
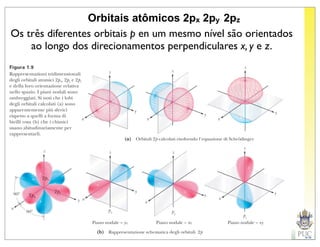
O documento descreve a estrutura atômica e as ligações químicas. Apresenta a cronologia dos modelos atômicos desde Dalton até Bohr e descreve a estrutura do núcleo atômico e dos orbitais eletrônicos. Explica como os elétrons são distribuídos nos átomos de acordo com as regras de preenchimento dos orbitais e como os átomos formam ligações iônicas e covalentes para atingir a configuração eletrônica de um gás nobre.







![Problema- Escreva a configuraçao eletronica do estado fundamental
de cada um dos seguiente elementos.
Princípio da edificação: Os orbitais são preenchidos de forma que os de mais baixa energia são
preenchido primeiro.
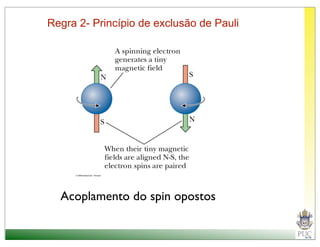
Princípio da exclusão de Pauli: No máximo dois elétrons com spins emparelhados pode ser
colocado em cada orbital.
Regra de Hund: Um elétron é adicionado a cada orbital degenerado antes de um segundo elétron
ser adicionado.
[B] [C] [N] [O] [F] [Ne]
[Si] e [Se]](https://image.slidesharecdn.com/2012cap01estruturaeligao-120808122428-phpapp01/85/2012-cap01-estrutura-e-ligacao-13-320.jpg)
![Configuração eletrônica do estado fundamental
de alguns elementos
O hidrogênio tem apenas um elétron que deve ocupar o orbital de mais baixa energia.
[H] Configuração 1S1
O carbono possui 6 elétrons e a configuração do seu estado fundamental é
[C] Configuração 1S2 2S2 2px1 2py1 = [He] 2S2 2p2](https://image.slidesharecdn.com/2012cap01estruturaeligao-120808122428-phpapp01/85/2012-cap01-estrutura-e-ligacao-14-320.jpg)