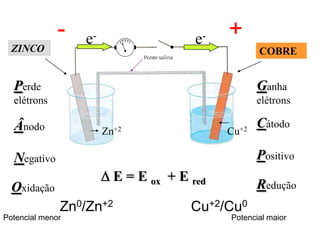
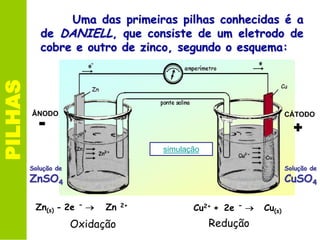
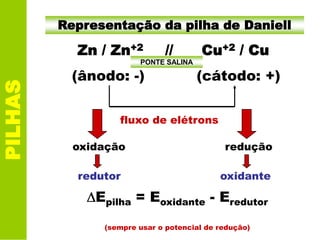
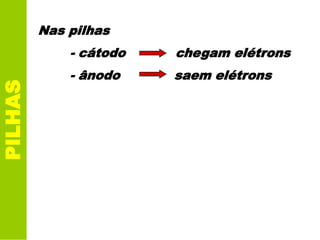
Este documento descreve os princípios básicos da eletroquímica e como as pilhas funcionam. Especificamente, explica que uma pilha converte energia química em energia elétrica através de reações de oxidação-redução entre dois metais, como zinco e cobre na pilha de Daniell. Também define o que é potencial de redução e como ele é usado para calcular o potencial da pilha.










![Cu+2
[ ]Zn+2
[ ]](https://image.slidesharecdn.com/eletroqumica-130920205233-phpapp02/85/Eletroquimica-14-320.jpg)