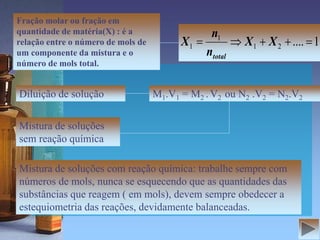
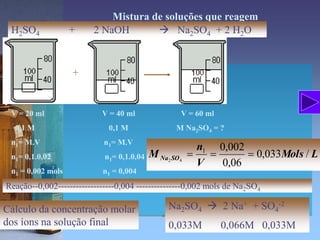
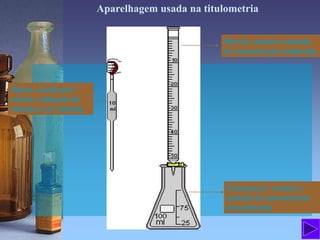
O documento fornece informações sobre soluções, concentrações, titulação e aparelhagem usada em análises volumétricas. É explicado que soluções são misturas homogêneas de substâncias e são definidos termos como solvente, soluto, solubilidade e tipos de soluções. Também são apresentadas diferentes maneiras de expressar a concentração de uma solução e a titulação é descrita como um processo para determinar a concentração de uma solução desconhecida usando uma solução de concentração conhecida.