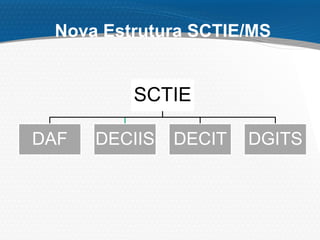
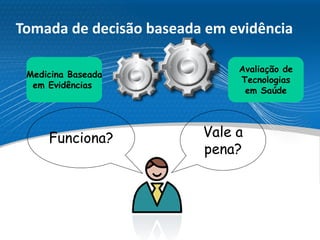
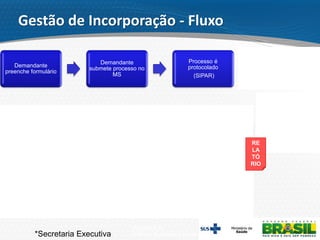
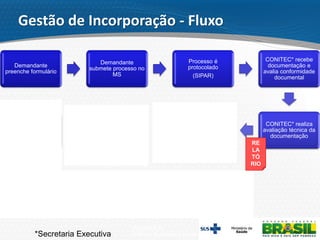
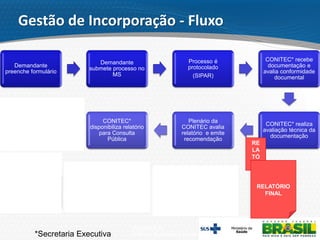
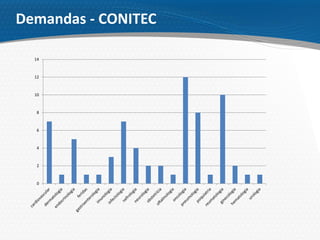
O documento descreve o processo de incorporação de tecnologias em saúde no Sistema Único de Saúde brasileiro (SUS). Apresenta a evolução do processo desde a Comissão de Incorporação de Tecnologias do Ministério da Saúde (CITEC) até a atual Comissão Nacional de Incorporação de Tecnologias no SUS (CONITEC), estabelecida pela Lei no 12.401/2011 para avaliar a incorporação de novas tecnologias no SUS com base em evidências científicas.