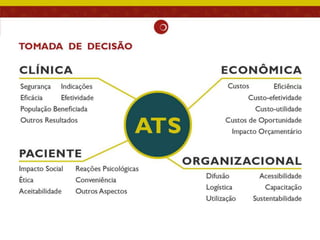
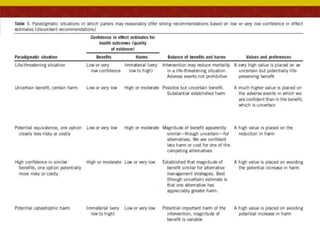
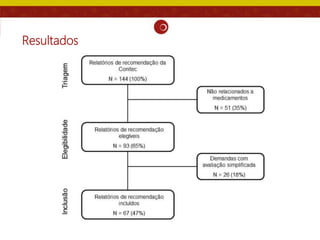
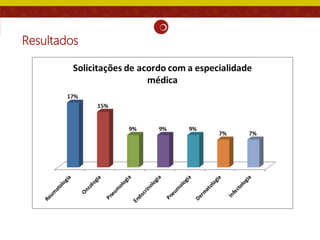
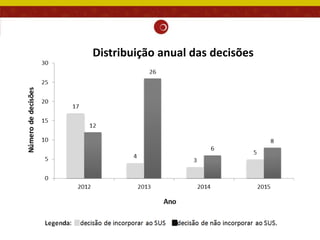
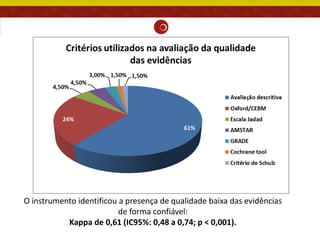
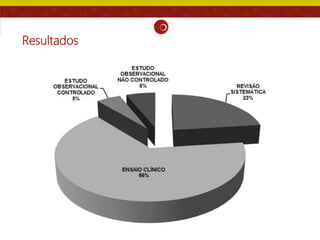
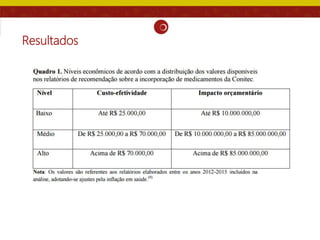
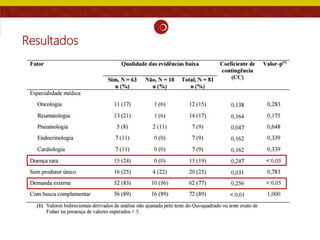
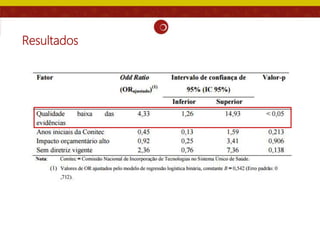
O documento analisa as recomendações da Comissão Nacional de Incorporação de Tecnologias no SUS (Conitec) e sua consistência com a qualidade das evidências apresentadas. Os autores examinaram relatórios de recomendação da Conitec e encontraram que as recomendações negativas estavam associadas à baixa qualidade das evidências e que as recomendações geralmente foram consistentes com os níveis de evidência apresentados.