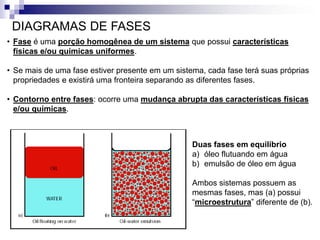
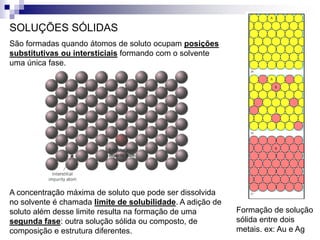
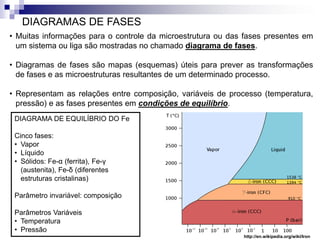
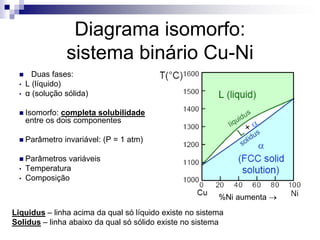
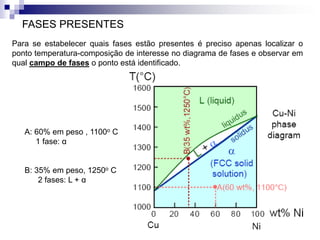
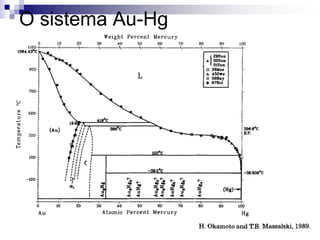
O documento discute diagramas de fases, definindo o que são fases e equilíbrio de fases. Explica como diagramas de fases ilustram as relações entre composição, variáveis de processo (temperatura, pressão) e fases presentes em condições de equilíbrio, permitindo prever transformações de fases e microestruturas.