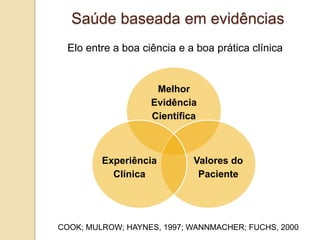
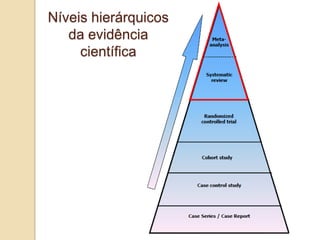
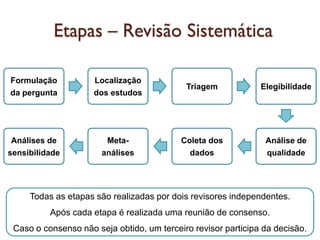
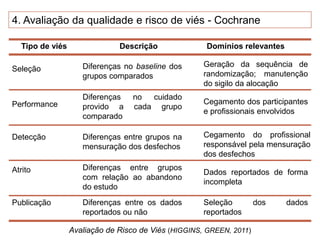
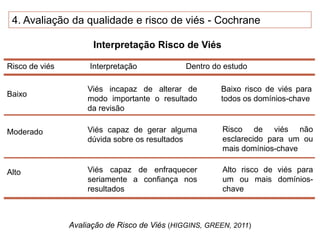
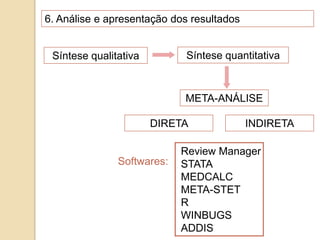
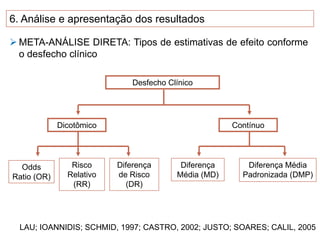
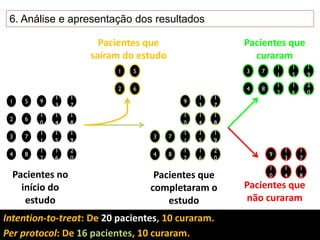
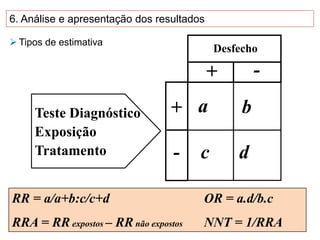
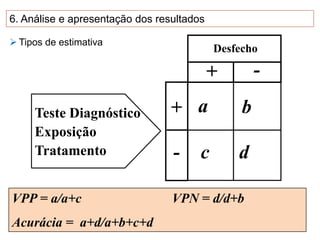
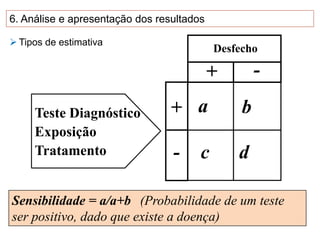
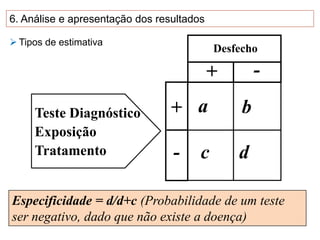
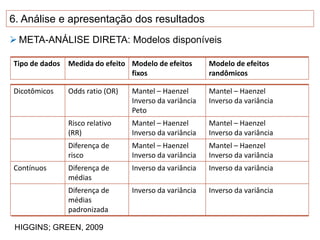
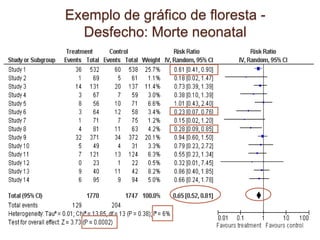
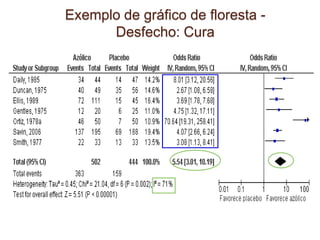
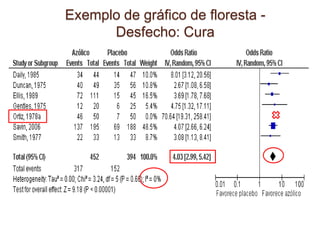
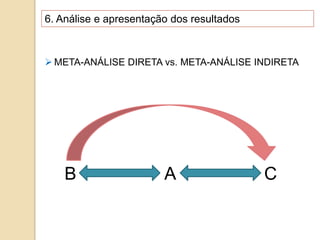
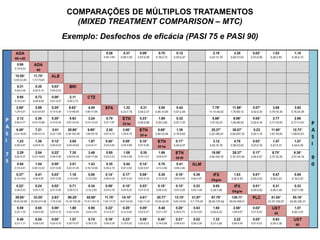
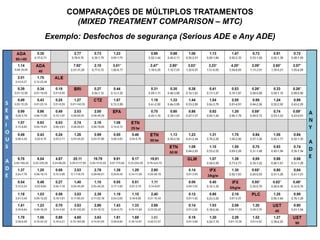
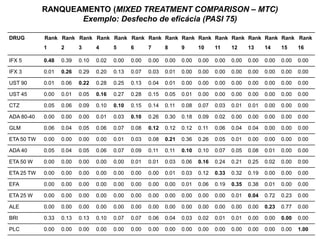
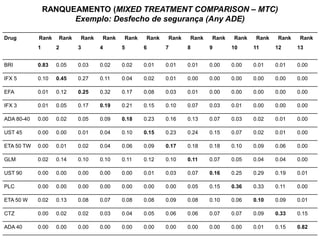
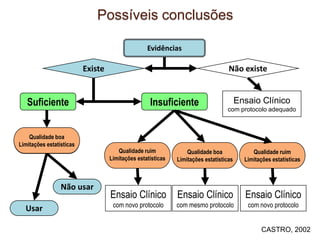
O documento discute a importância da saúde baseada em evidências para a tomada de decisão clínica. Apresenta os níveis hierárquicos da evidência científica, com ensaios clínicos randomizados no nível mais alto. Também explica as etapas de uma revisão sistemática, que sintetiza de forma rigorosa as pesquisas sobre um tema, fornecendo a melhor evidência para guiar a prática.