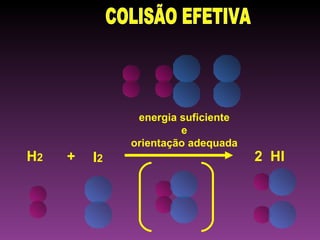
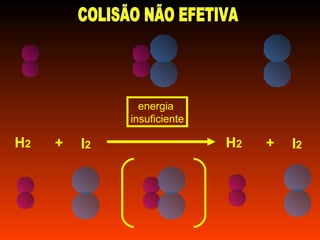
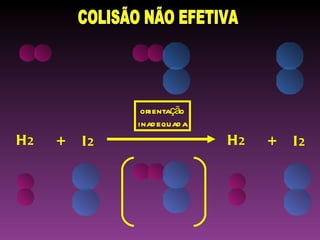
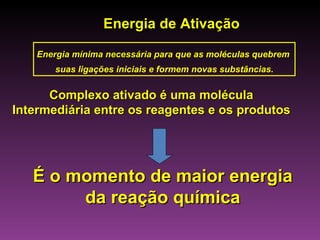
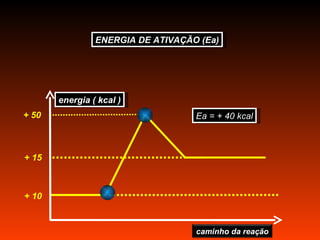
O documento discute a cinética química, que estuda a velocidade das reações. Explica que a velocidade de uma reação depende da energia e orientação das colisões entre moléculas, assim como da concentração dos reagentes, temperatura, pressão e uso de catalisadores. Também mostra exemplos de cálculo da velocidade média de uma reação.

![É calculada pela relação entre a quantidade
de um reagente (ou produto) que é
consumido (ou produzido)
e o intervalo de tempo gasto.
Ex: 2A + B → 2C
Obs.: A velocidade de consumo de A é igual a de formação de C.
Obs2.: A velocidade de consumo de B é a metade da do
consumo de A e da de formação de C.
VM = [ final ] – [ inicial ]
t final – t inicial](https://image.slidesharecdn.com/cinetica-pptdaniela-120605190103-phpapp01/85/Cinetica-ppt-daniela-2-320.jpg)
![Cálculo da Velocidade Média
Tempo [A] [B] [C]
(min) (mol/L) (mol/L) (mol/L)
0 12,8 6,4 0 2A + B → 2C
2 6,4 3,2 6,4
4 3,2 1,6 9,6 Vm de A no intervalo de tempo
de 0 a 8h:
6 1,6 0,8 11,2
8 0,8 0,4 12,0
10 0,4 0,2 12,4
12 0,2 0,1 12,6
∆A 0,8 – 12,8
Vm = = = 1,5 mol/L.min
∆t 8- 0](https://image.slidesharecdn.com/cinetica-pptdaniela-120605190103-phpapp01/85/Cinetica-ppt-daniela-3-320.jpg)
![Graficamente: 2A + B → 2C
[A]
[B]
14 [C]
12
Reagentes:
10
A concentração diminui
Concentração (mol/L)
8 à medida que ocorre a
6 reação
4
2 Produtos:
0
A concentração aumenta
-2
0 2 4 6 8 10 12 à medida que ocorre a
Tempo (min) reação](https://image.slidesharecdn.com/cinetica-pptdaniela-120605190103-phpapp01/85/Cinetica-ppt-daniela-4-320.jpg)