1) O documento discute cinética química, que estuda a velocidade das reações. A velocidade média de uma reação é calculada pela variação de concentração dos reagentes ou produtos em relação ao tempo.
2) Vários fatores influenciam a velocidade das reações, como a temperatura, concentração dos reagentes, presença de catalisadores e estado físico dos reagentes.
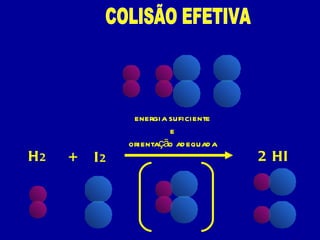
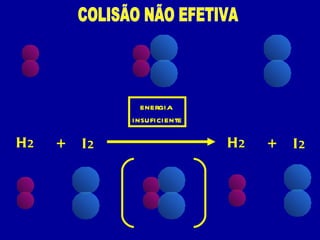
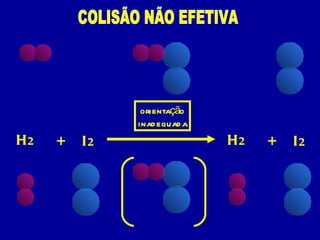
3) A velocidade de uma reação depende da frequência e energia das colisões entre moléculas, orientação das molé





![É calculada pela relação entre a quantidade de um reagente (ou produto) que é consumido (ou produzido) e o intervalo de tempo gasto para isto v = [ final ] [ inicial ] – final t – inicial t M](https://image.slidesharecdn.com/cinetica-110401145728-phpapp02/85/Cinetica-6-320.jpg)

![A quantidade de reagente ou produto medida em mol/L é representada por [ ]](https://image.slidesharecdn.com/cinetica-110401145728-phpapp02/85/Cinetica-8-320.jpg)




![Ex. 05 Pag. 38 05) (Ufscar – SP) Para a reação A + 2 B C, com concentrações iniciais de A e B iguais a 8,5 molar e 15 molar, respectivamente, colheram-se os seguintes dados em laboratório: tempo (h) 0 1,0 2,0 3,0 4,0 [C] 0 3,0 4,5 5,0 5,5 Calcule: a) A velocidade média da reação no intervalo de tempo de 1h e 3h. a) A concentração de A no tempo de 4h v = 5,0 – 3,0 3 – 1 = 2,0 2 = 1 mol/L x h Em 4 h são produzidos 5,5 mol/L de C, que tem a mesma velocidade de consumo de A, 5,5 mol/L Em 4 h restarão 8,5 – 5,5 = 3,0 mol/L](https://image.slidesharecdn.com/cinetica-110401145728-phpapp02/85/Cinetica-13-320.jpg)














![Para uma reação genérica: a A + b B Produtos A velocidade da reação é dada pela expressão: Onde os valores de “ x ” e “ y ” são determinados experimentalmente Esta equação é conhecida pelo nome de LEI DA VELOCIDADE v = k [ A ] [ B ] x y](https://image.slidesharecdn.com/cinetica-110401145728-phpapp02/85/Cinetica-33-320.jpg)
![Para as reações ELEMENTARES os valores dos expoentes são iguais aos coeficientes das substâncias na equação química 2 NO (g) + H 2 (g) N 2 O (g) + H 2 O (g) v = k [ NO ] [ H 2 ] 2 Para a reação: A lei da velocidade é :](https://image.slidesharecdn.com/cinetica-110401145728-phpapp02/85/Cinetica-34-320.jpg)
![Se uma reação ocorrer em várias etapas sua velocidade é dada pela ETAPA MAIS LENTA A + A A 2 ( etapa lenta ) A 2 + B A 2 B ( etapa rápida ) 2 A + B A 2 B ( reação global ) v = k [ A ] 2 A lei da velocidade é:](https://image.slidesharecdn.com/cinetica-110401145728-phpapp02/85/Cinetica-35-320.jpg)
![01) A reação A + 2 B P se processa em uma única etapa. Qual a velocidade desta reação quando K = 0,3 L/mol . min, [A] = 2,0 M e [B] = 3,0 M ? a) 5,4. b) 4,5. c) 1,8. d) 18,0. e) 54. v = k [ A ] [ B ] 2 k = 0,3 L / mol . min [ A ] = 2,0 M [ B ] = 3,0 M = 0,3 x 2 x 3 2 = 0,3 x 2 x 9 v = 5,4](https://image.slidesharecdn.com/cinetica-110401145728-phpapp02/85/Cinetica-36-320.jpg)
![02) (Unip-SP) A poluição é uma das causas da destruição da camada de ozônio. Uma das reações que podem ocorrer no ar poluído é a reação do dióxido de nitrogênio com o ozônio: 2 NO 2 (g) + O 3 (g) N 2 O 5 (g) + O 2 (g) Essa reação ocorre em duas etapas: I. NO 2 (g) + O 3 (g) NO 3 (g) + O 2 (g) (lenta) II. NO 3 (g) + NO (g) N 2 O 5 (g) (rápida) Assinale a lei de velocidade para essa reação: v = k [NO 2 ] [O 3 ] v = k [NO 2 ] [O 3 ] v = k [NO 3 ] [NO 2 ] v = k [NO 2 ] [O 3 ] + k’ [NO 3 ] [NO 2 ] v = k [NO 2 ] 2 2 Pág. 45 Ex. 11](https://image.slidesharecdn.com/cinetica-110401145728-phpapp02/85/Cinetica-37-320.jpg)
![03) Na decomposição térmica da amônia expressa pela equação: 2 NH 3 (g) N 2 (g) + 3 H 2 (g) Duplicando-se a concentração molar de NH 3 , a velocidade da reação ficará: a) inalterada. b) duas vezes maior. c) três vezes maior. d) quatro vezes maior. e) seis vezes maior. v = k [ NH 3 ] 2 [ NH 3 ] = x mol /L v = k x 2 [ NH 3 ] = 2x mol /L v’ = k ( 2x ) 2 v’ = k x 4 2 v’ = 4 v](https://image.slidesharecdn.com/cinetica-110401145728-phpapp02/85/Cinetica-38-320.jpg)
![04) Unisinos-RS) Na Química ambiental, que procura, entre outras coisas, avaliar formas de atenuar a emissão de substâncias gasosas que depreciam a qualidade do ar; a reação entre os gases monóxido de carbono e oxigênio, para produzir dióxido de carbono, tem grande importância. A equação representativa dessa reação é: 2 CO (g) + O 2 (g) 2 CO 2 (g) v 1 v 2 Quando se duplicarem, simultaneamente, as concentrações molares de CO e O 2 , efetuando a reação em sistema fechado, por quantas vezes ficará multiplicada a velocidade da reação “v”? 2. 4. 8. 16. 32. Pág. 45 Ex. 10 v = k [CO] [O 2 ] 2 [CO 2 ] = x mol/L [O 2 ] = y mol/L 2 v = k x y [CO 2 ] = 2x mol/L [O 2 ] = 2y mol/L 2 v’ = k (2x) (2y) 2 v’ = 8 v k x y](https://image.slidesharecdn.com/cinetica-110401145728-phpapp02/85/Cinetica-39-320.jpg)
![05) A tabela abaixo apresenta os valores das velocidades de reação e as correspondentes concentrações em mol / L dos reagentes em idênticas condições, para o processo químico representado pela equação: 3 X + 2 Y Z + 5 W velocidade [ X ] [ Y ] 10 10 10 10 10 40 40 20 5 Qual a equação de velocidade desse processo? v = k [ X ] [ Y ] b x a 1 2 3 1 2 = 10 40 k k x x x 10 5 b a b a 10 10 x 2 3 = 40 40 k k x x x 10 10 b 2 b 2 20 10 4 = 2 a = 2 a 2 2 a = 2 1 = 2 b = 2 b 2 0 b = 0 v = k [ X ] [ Y ] 0 2 ou v = k [ X ] 2 Pág. 44 Ex. 08](https://image.slidesharecdn.com/cinetica-110401145728-phpapp02/85/Cinetica-40-320.jpg)
![06) (Urca-CE) Dada a seguinte reação genérica “2 A + B C” e o quadro cinético abaixo: É correto afirmar: é uma reação elementar. a ordem global da reação é 2. a lei de velocidade é v = k[A] 2 [B]. a constante de velocidade é igual a 1. a lei de velocidade é v = k[A][B] 2 . v = k [A] [B] x y = 2 1 1,80 0,20 k . (0,42) (0,63) x y k . (0,42) (0,21) x y 9 = 3 y y = 2 = 3 1 0,40 0,20 k . (0,84) (0,21) x y k . (0,42) (0,21) x y 2 = 2 x x = 1 v = k [A] [B] 2 0,40 0,21 0,84 III 1,80 0,63 0,42 II 0,20 0,21 0,42 I Velocidade (mol/L.s) [B] mol/L [A] mol/L Experiência](https://image.slidesharecdn.com/cinetica-110401145728-phpapp02/85/Cinetica-41-320.jpg)