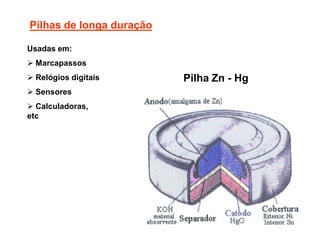
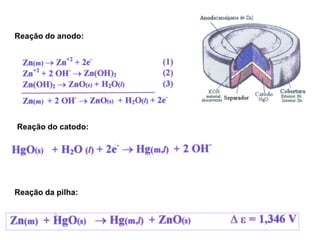
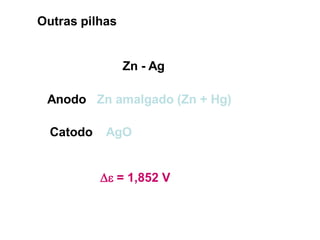
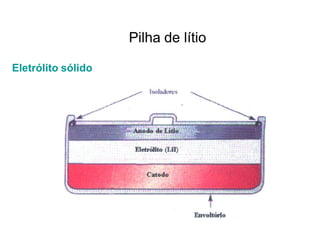
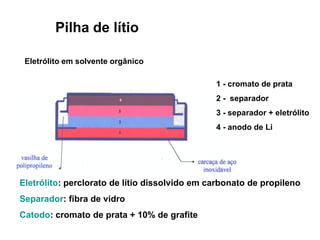
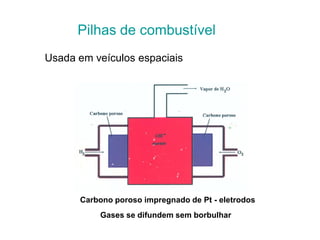
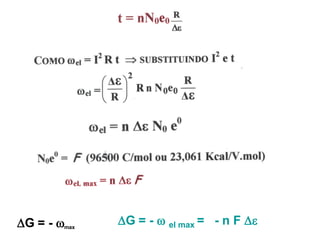
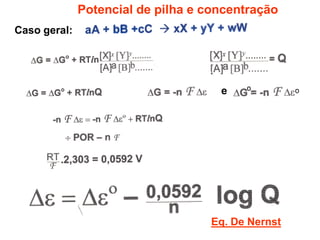
O documento discute o potencial de pilhas, definindo força eletromotriz (f.e.m) como a força que move os elétrons em uma pilha, medida em volts. Explica que a f.e.m depende da natureza das reações químicas, concentração das espécies e temperatura. Também define potencial padrão de pilha como a f.e.m quando as condições são concentração de 1M, pressão de 1 atm e temperatura de 25°C.
















![Fe(s) Fe2+(aq,10-3 M) Cl-(aq, 10-2 M) Cl2(g, P=1 atm) Pt(s)
o = 1,360 –(-0,440) = 1,800 V
Fe (m) + Cl2(g) Fe2+(aq) + 2 Cl- (aq)
2 2
[Fe ][ Cl ] -3 2 2 7
Q 10 .( 10 ) 10
1
0 , 0592
o – log Q
n
= 1,800 – (0,0296 . -7) = 1,800 + 0,207
= 2,007 V](https://image.slidesharecdn.com/aulaeletro2-121025183946-phpapp02/85/Eletroquimica-2-21-320.jpg)