O documento discute equilíbrio químico e titulometria de precipitação. Aborda conceitos como solubilidade de sólidos iônicos, constante de produto de solubilidade, efeito do íon comum, critérios para precipitação, curvas de titulação, e indicadores de precipitação.


![A constante produto de solubilidade, Kps
• A constante de equilíbrio para o equilíbrio estabelecido entre
um sólido pouco solúvel e seus íons em uma solução saturada
CaSO4(s) Ca2+(aq) + SO4
Kps = [Ca2+][SO4
2-(aq)
2-] = 9,1x10-6 a 25°C](https://image.slidesharecdn.com/04-141206160056-conversion-gate02/85/04-equilibrio-e-titulacao-de-precipitacao-prova-3-320.jpg)
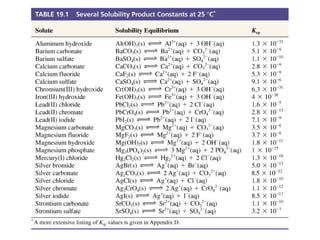
![A relação entre solubilidade e Ksp
• Solubilidade molar
– A molaridade numa solução
aquosa saturada
– Relacionada com o Kps
g BaSO4/100 mL → mol BaSO4/L
→ [Ba2+] e [SO4
2-]
→ Kps = 1,1x10-10
Celobar](https://image.slidesharecdn.com/04-141206160056-conversion-gate02/85/04-equilibrio-e-titulacao-de-precipitacao-prova-5-320.jpg)
![Critério para precipitação
AgI(s) Ag+(aq) + I-(aq)
Ksp = [Ag+][I-] = 8,5x10-17
Misturar AgNO3(aq) e KI(aq) para obter uma
solução que é 0,010 M em Ag+ e 0,015 M em I-.
Saturada, supersaturada ou insaturada?
Q = [Ag+][I-] = (0,010)(0,015) = 1,5x10-4 > Kps](https://image.slidesharecdn.com/04-141206160056-conversion-gate02/85/04-equilibrio-e-titulacao-de-precipitacao-prova-8-320.jpg)


![Exemplo 1
a concentração de I- na solução:
[I-] =
3x10-5 mol I-
0,1000 L
= 3x10-4 mol I-Determinar
Aplicar o critério de precipitação:
Q = [Pb2+][I-]2 = (0,010)(3x10-4)2
= 9x10-10 < K= 7,1x10-9
ps
Não há precipitação](https://image.slidesharecdn.com/04-141206160056-conversion-gate02/85/04-equilibrio-e-titulacao-de-precipitacao-prova-11-320.jpg)



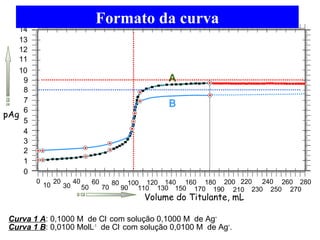
![Exemplo 2
100 mL de solução 0,1000 M de NaCl é titulado com solução
0,1000 M de AgNO3. Fazer uma previsão da Curva de
Titulação de Precipitação.
Resolução.
Deve-se considerar primeiramente a reação de precipitação:
Para a previsão teórica da Curva de Titulação, deve-se calcular os
valores de pCl (-log [Cl-]) em função do volume adicionado do titulante
(A) No início da titulação, pCl é calculado a partir da concentração do
titulado
Ag+ + Cl- AgCl(s)
KPS = [Cl-] [Ag+] = 1,0x10-10
pCl = - log [Cl-] = - log 1,0 x 10-1 = 1,0](https://image.slidesharecdn.com/04-141206160056-conversion-gate02/85/04-equilibrio-e-titulacao-de-precipitacao-prova-15-320.jpg)
![Exemplo 2
(B) Após a adição de 5,00 mL do titulante, tem-se o seguinte:
5,00 mL x 0,1000 MolL-1 = 0,50 milimol de Ag+
Na solução original o número de milimoles é calculado por:
100 mL x 0,1000 M = 10,00 milimoles de Cl-
10,00 milimoles de Cl- - 0,50 milimol de Cl- = 9,50 milimoles de Cl-
Vtotal = 100,0 + 5,0 = 105,0 mL
[Cl-] (M) = 9,50 milimoles/105,0 mL
pCl = -log (9,50/105,0) = 1,04
(C) Para outros valores de volume do titulante, o raciocínio é o mesmo.
Por exemplo, considerando-se 50,0 mL do titulante (Ag+) o cálculo :
50,00 mL x 0,1000 M1 = 5,00 milimoles de Ag+](https://image.slidesharecdn.com/04-141206160056-conversion-gate02/85/04-equilibrio-e-titulacao-de-precipitacao-prova-16-320.jpg)
![Exemplo 2
10,00 milimoles de Cl- - 5,00 milimol de Cl- = 5,00 milimoles de Cl-
Vtotal = 100,0 + 50,0 = 150,0 mL
[Cl-] (M ) = 5,00 milimoles /150,0 mL
pCl = -log (5,00/150,0) = 1,48
(D) No ponto de equivalência, ou seja, 100 ml de titulante, o cálculo
segue outras regras. Deve-se levar em consideração o KPS:
KPS = [Cl-][Ag+] = 1,0x10-10
Neste ponto, o sólido AgCl está em equilíbrio com a água, e:
[Cl -] = [Ag+] = (KPS)1/2 = (1,0 x 10-10)1/2 = 1,0 x 10-5 M
pCl = -log [Cl-] = - log 1,0 x 10-5 = 5,00
(E) Considerando-se um ponto bem próximo do Ponto de Equivalência, ou seja, 100,1 mL do
titulante, sobra 0,1 mL de solução de Ag+:](https://image.slidesharecdn.com/04-141206160056-conversion-gate02/85/04-equilibrio-e-titulacao-de-precipitacao-prova-17-320.jpg)
![Exemplo 2
0,1 mL x 0,1000 = 0,01 milimol de íons Ag+
Vtotal = 100,0 + 100,1 = 200,1 mL
[Ag+] = 0,01 milimol/ 200,1 mL = 0,01 / 200,1 M
[Cl-] = 1,0 x 10-10 / [Ag+] = 1,0 x 10-10 / (0,01 / 200,1)
[Cl-] = 200,1 x (1,0 x 10-10) / 0,01 = 2,0 x 10-6 M
pCl = -log 2,0 x 10-6 = 5,70
(E) Após o ponto de equivalência, por exemplo, 110 mL do
titulante, sobram 10 mL de solução de Ag+:
10,0 mL x 0,1000 = 1,0 milimol de íons Ag+
Vtotal = 100,0 + 110,0 = 210,0 mL
[Ag+] = 1,0 milimol/ 210,0 mL = 1,0 / 210,0 M
[Cl-] = 1,0 x 10-10 / [Ag+] = 1,0 x 10-10 / (1,0 / 210,0)
[Cl-] = 210 x (1,0 x 10-10) = 2,10 x 10-8 M
pCl = -log 2,10 x 10-8 = 7,68](https://image.slidesharecdn.com/04-141206160056-conversion-gate02/85/04-equilibrio-e-titulacao-de-precipitacao-prova-18-320.jpg)
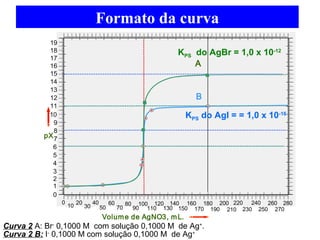

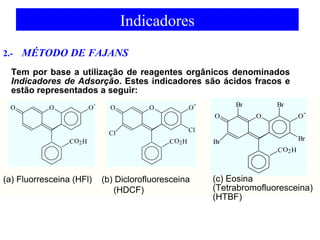
![Indicadores
Em titulações de Precipitação, conforme o sistema indicador
utilizado, define-se o método de titulação. Basicamente, existem os
seguintes Métodos de Precipitação:
1.- MÉTODO DE MÖHR
Reação de Titulação: Cl- + Ag+ AgCl(s)
KPS1 = [Cl-][Ag+] = 1,0 x 10-10
BRANCA
AMARELADA
KPS2 = [CrO4
=][Ag+]2 = 1,0x10-12
VERMELHO
TIJOLO
Reação Indicadora: Cro4
=+ 2 Ag+ Ag2CrO4 (s)](https://image.slidesharecdn.com/04-141206160056-conversion-gate02/85/04-equilibrio-e-titulacao-de-precipitacao-prova-22-320.jpg)