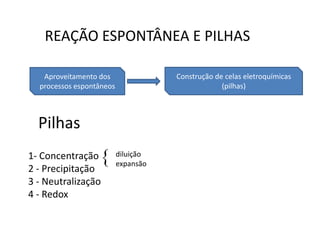
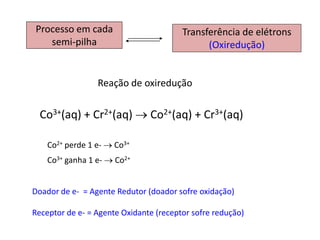
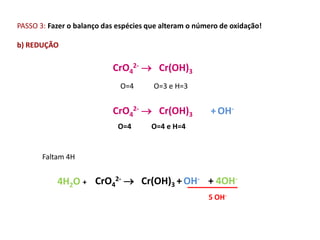
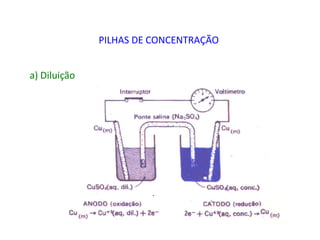
1. O documento descreve quatro tipos principais de pilhas: concentração, expansão gasosa, neutralização e redox.
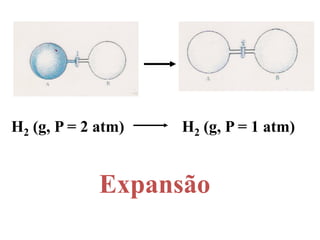
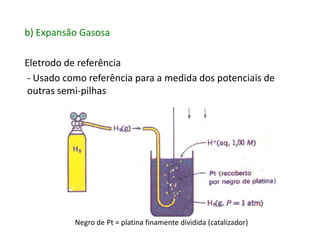
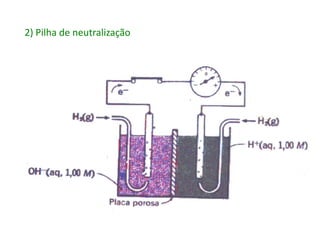
2. As pilhas de concentração aproveitam a diferença de concentração de íons em soluções, as de expansão gasosa usam a diferença de pressão parcial de gases, as de neutralização usam reações ácido-base e as redox usam reações de oxidação-redução.
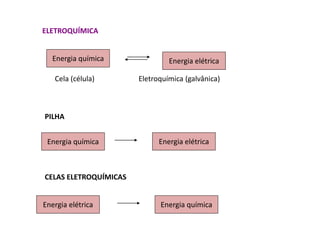
3. Esses tipos de pilhas constroem células eletroquímicas que convertem energia quím











![Exemplos de aplicação de regras
NO N= O=
NO2 N= O=
MnO4- Mn= O=
HONO2 H= N= O=
HCrO4- H= Cr= O=
H2O2 H= O=
[Fe(H2O)2]2+ Fe= H= O=
LiH Li= H=](https://image.slidesharecdn.com/aulaeletro1-121023140338-phpapp01/85/Eletroquimica-17-320.jpg)









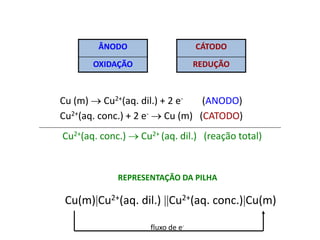



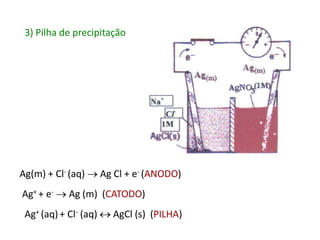
![[Ag+ ] EM SOLUÇÃO?
Kps = [Ag+][Cl-]
[Cl-] = 1 M [Ag+] = Kps/[Cl-]
REPRESENTAÇÃO DA PILHA
Ag(m)Ag+(Kps M), Cl- (1 M) Ag+(1 M) Ag(m)
fluxo de e-](https://image.slidesharecdn.com/aulaeletro1-121023140338-phpapp01/85/Eletroquimica-36-320.jpg)
