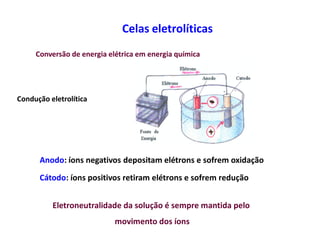
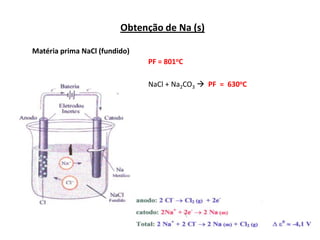
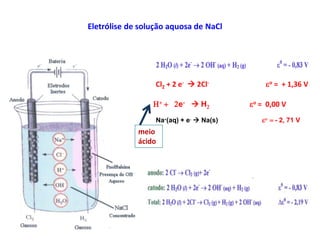
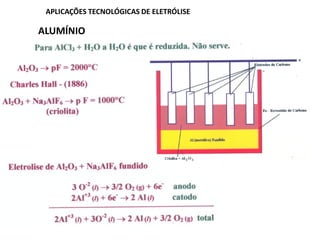
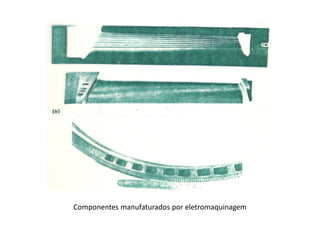
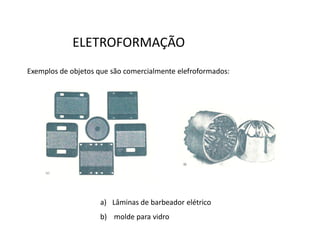
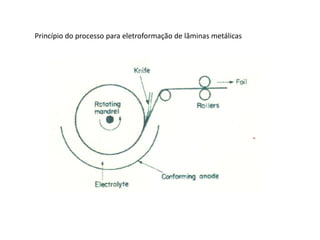
A eletrólise é o processo oposto à descarga de uma pilha e tem grande uso industrial para a produção de metais como sódio, alumínio e cobre. As células eletrolíticas convertem energia elétrica em energia química através da oxidação no ânodo e redução no cátodo. A eletrólise depende do potencial aplicado e do meio ambiente para determinar os produtos formados.