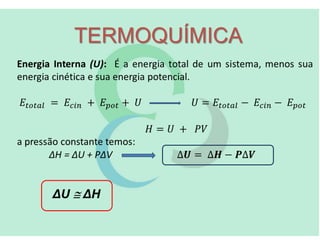
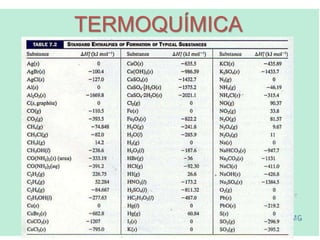
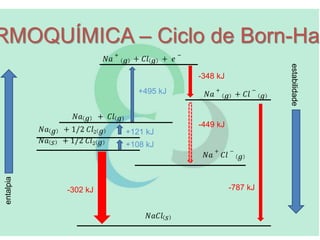
A termoquímica estuda as quantidades de calor envolvidas em reações químicas. A termoquímica mede e relaciona as quantidades de calor liberadas ou absorvidas em reações, usando propriedades como entalpia e calor de reação. A Lei de Hess permite calcular as variações de entalpia de reações complexas a partir das variações das etapas elementares.