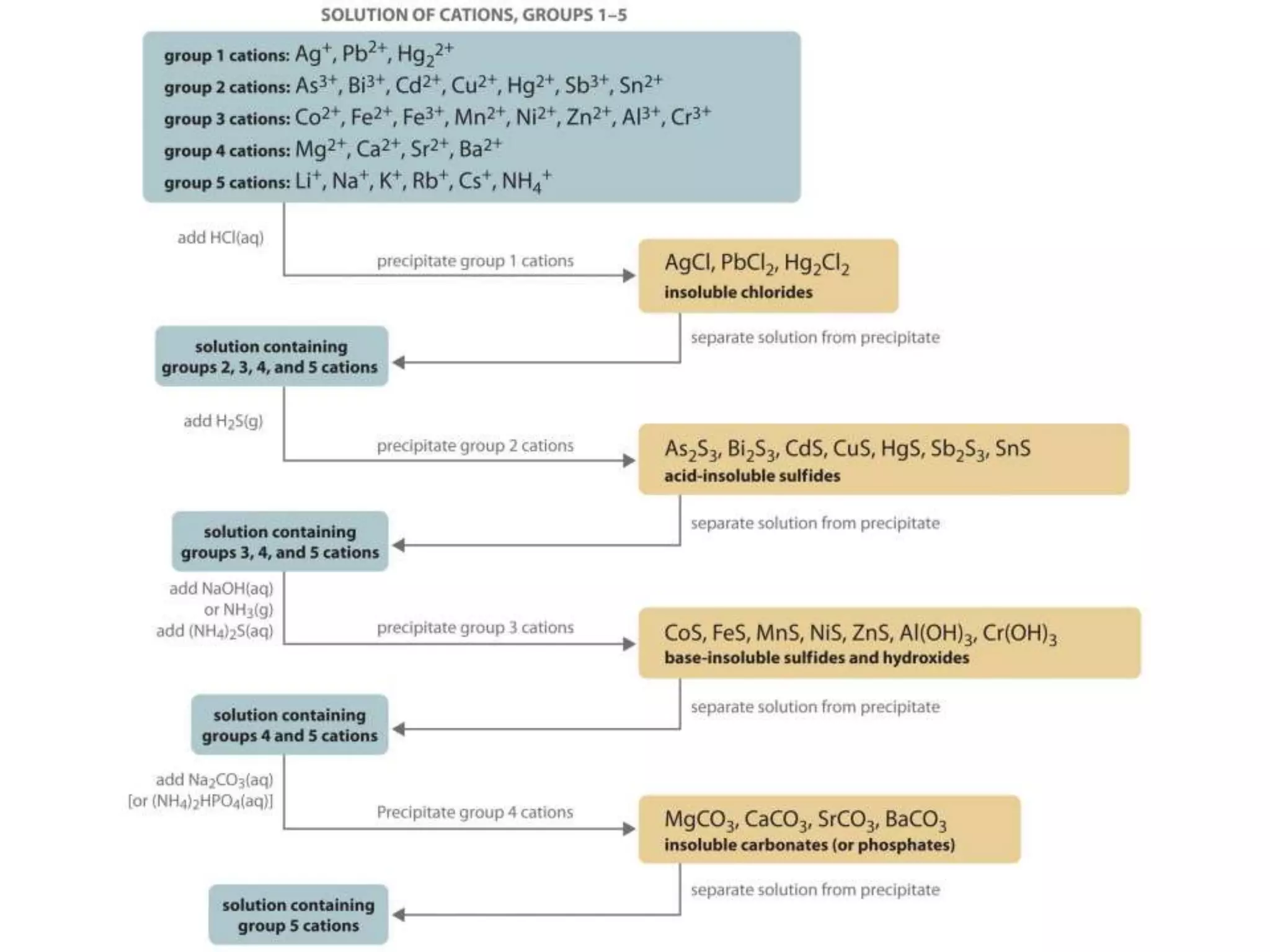
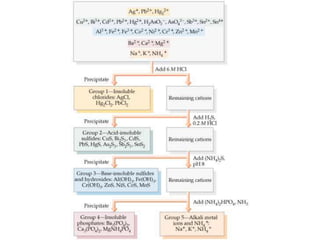
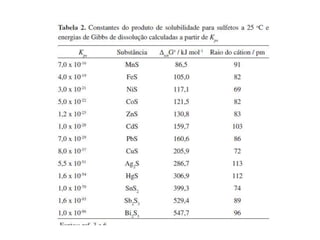
O documento discute procedimentos analíticos qualitativos para a identificação de cátions em grupos. Apresenta perguntas sobre os grupos 3-4 de cátions, incluindo sua solubilidade e separações. Também cobre grupos 4-5, reações químicas de identificação e o uso de reagentes como NH4OH e H2O2.