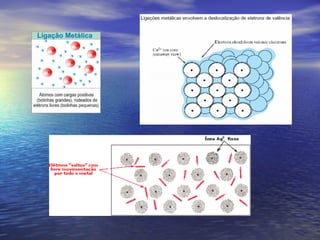
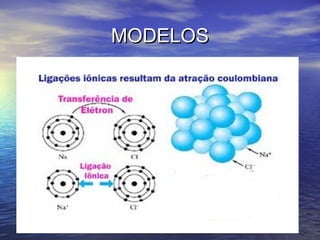
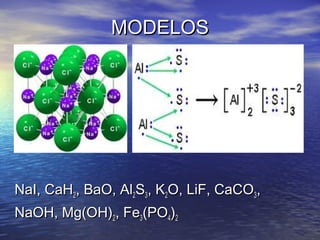
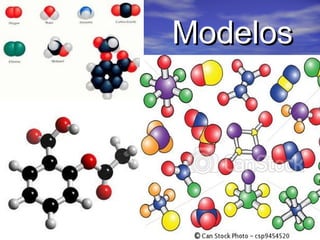
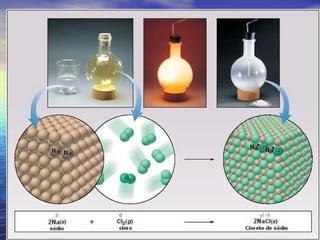
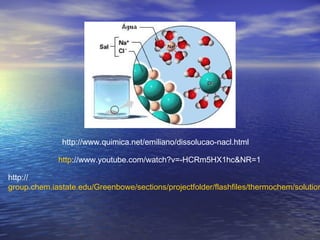
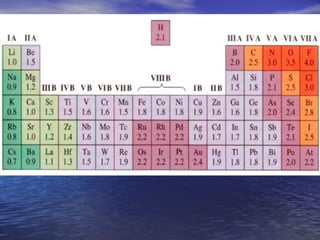
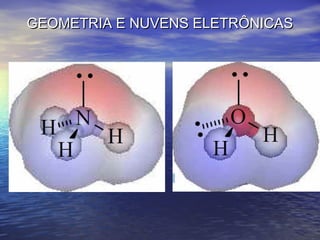
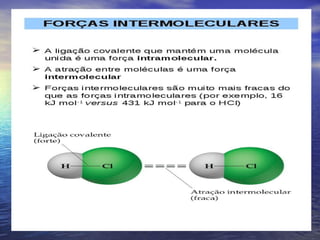
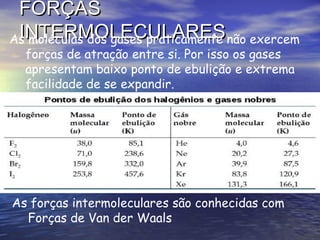
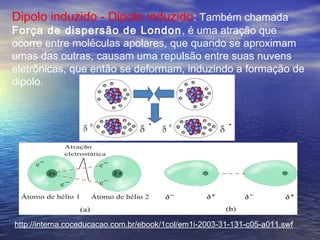
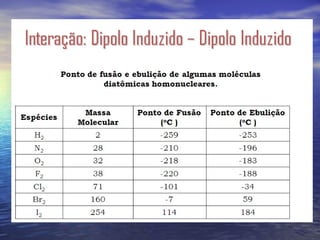
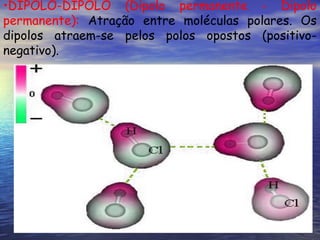
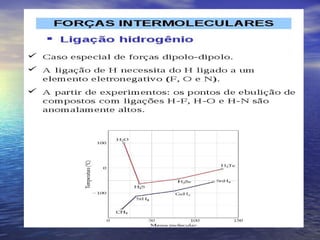
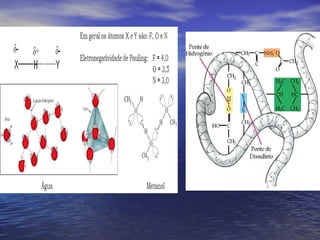
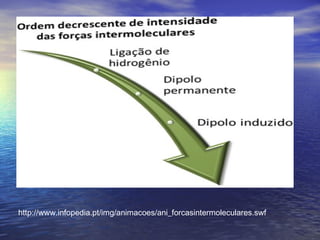
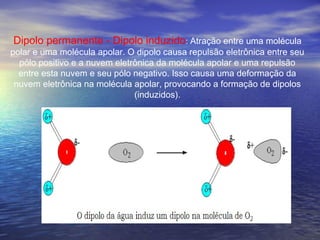
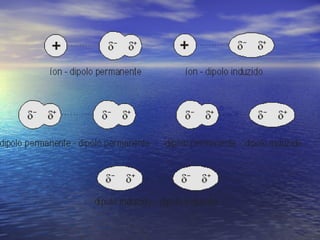
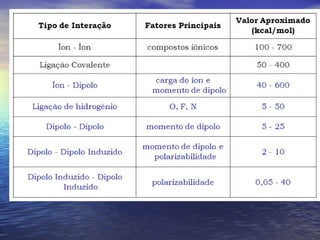
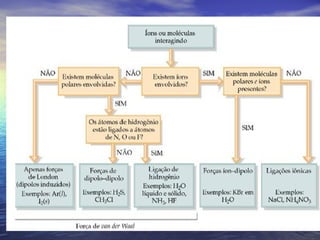
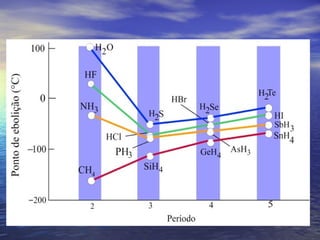
O documento descreve três tipos principais de ligação química: ligação metálica, ligação iônica e ligação covalente. A ligação metálica ocorre entre cátions através de elétrons livres em um retículo cristalino. A ligação iônica ocorre entre cátions e ânions através de transferência de elétrons. A ligação covalente envolve o compartilhamento de elétrons entre átomos.