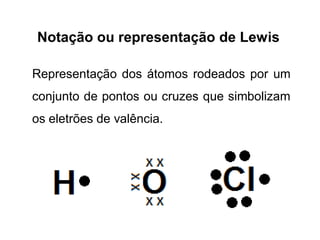
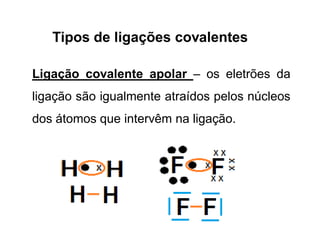
Os átomos formam ligações químicas para atingir uma situação mais estável, resultando em moléculas com menor energia do que átomos não ligados. Existem quatro tipos principais de ligação: iónica, metálica, covalente e covalente polar/apolar. As ligações covalentes podem ser simples, duplas ou triplas dependendo do número de pares de elétrons partilhados.