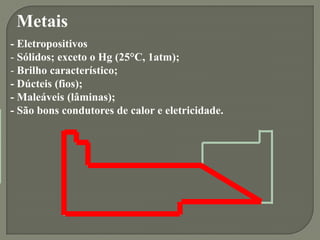
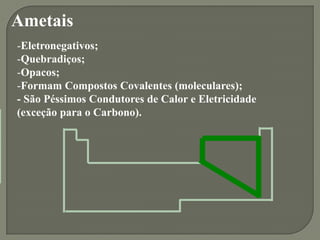
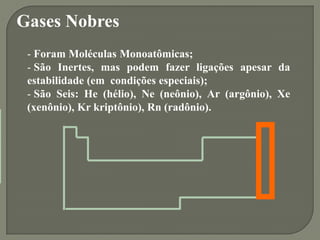
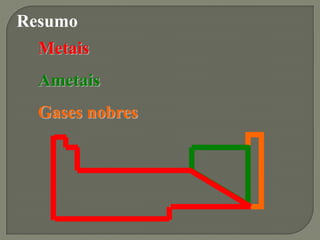
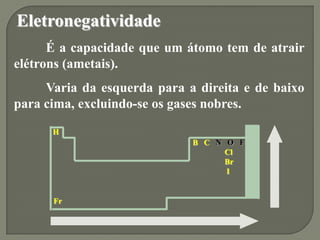
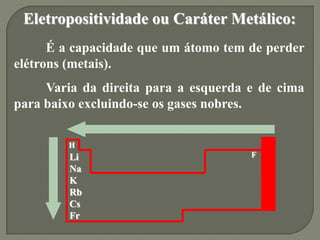
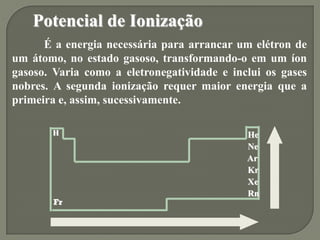
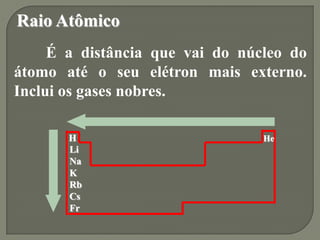
1) A tabela periódica organiza os elementos de acordo com suas propriedades periódicas e seu número atômico, dividindo-os em metais, não metais e gases nobres.
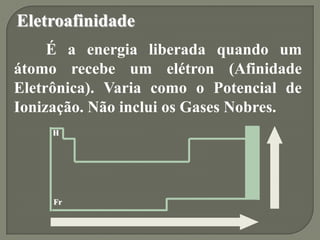
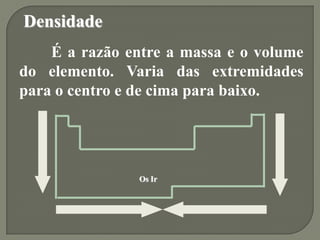
2) As propriedades periódicas como eletronegatividade, potencial de ionização e raio atômico variam de acordo com a posição dos elementos na tabela periódica.
3) A tabela possui 7 períodos horizontais indicando os níveis eletrônicos e famílias verticais com elementos de propriedades químicas semel