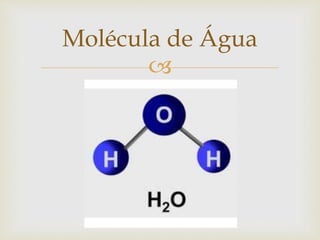
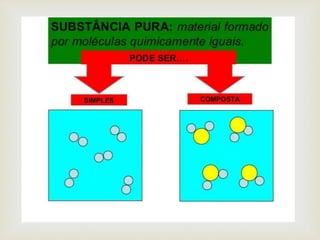
O documento explica que átomos formam moléculas que por sua vez formam substâncias. Átomos consistem em núcleos de prótons e nêutrons cercados por elétrons. Moléculas são formadas por átomos ligados e definem o tipo de substância, que pode ser pura, composta por uma ou mais moléculas, ou impura, contendo diferentes sistemas físicos.