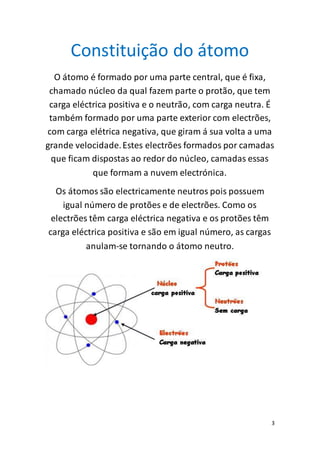
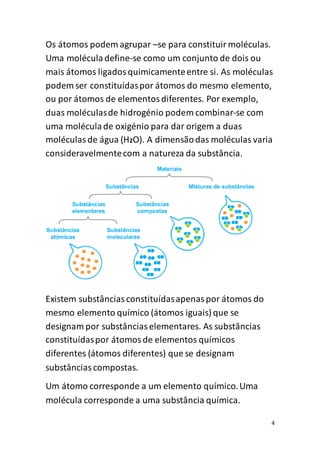
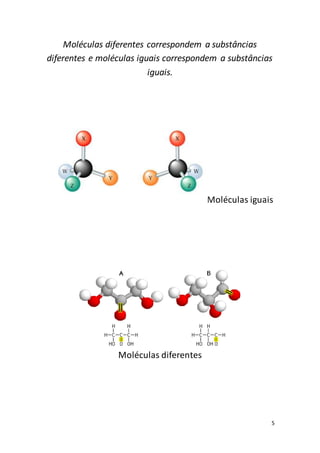
O documento discute os conceitos básicos de átomos e moléculas. Explica que a matéria é constituída por átomos em constante movimento e que os átomos podem combinar-se para formar moléculas ou substâncias. Também descreve a estrutura interna dos átomos e a nomenclatura usada para descrever moléculas com diferentes números de átomos.