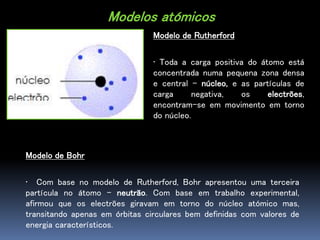
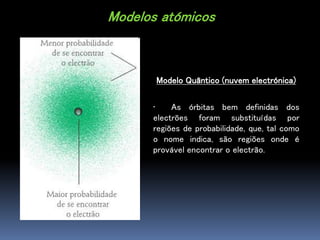
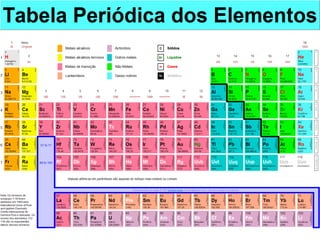
O documento descreve a evolução dos modelos atômicos ao longo do tempo, começando com o modelo de Dalton, passando pelo modelo de Thomson, Rutherford e Bohr, até chegar no modelo quântico atual. Também define os elementos químicos em termos de seu número atômico e de massa, e fornece um exemplo com o elemento flúor.