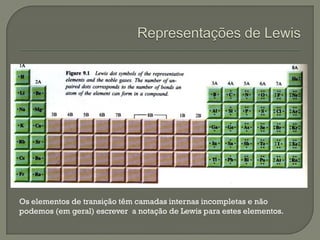
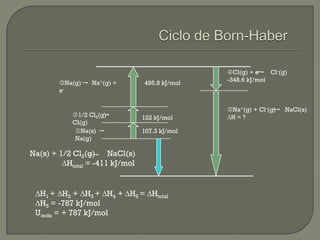
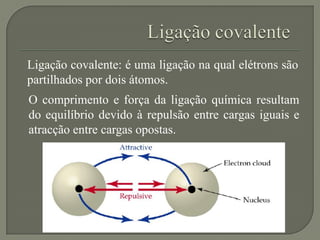
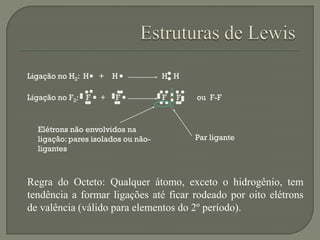
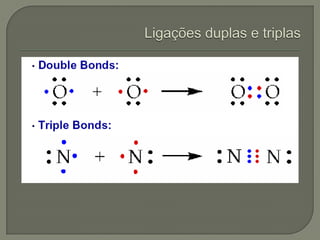
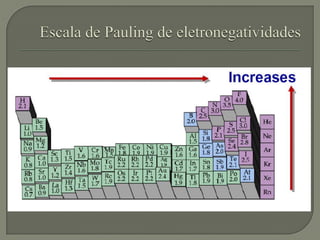
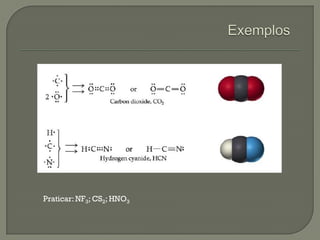
O documento discute os conceitos de ligação química, estruturas de Lewis e regra do octeto. Explica que as ligações químicas mantêm os átomos unidos através de forças eletrostáticas entre cargas elétricas. Detalha os tipos principais de ligação - iônica, covalente e metálica - e como cada uma é formada.