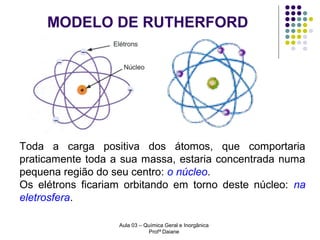
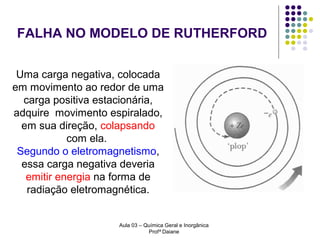
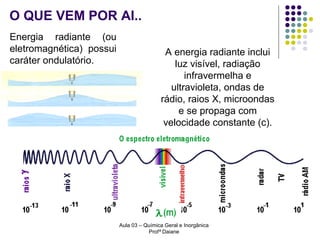
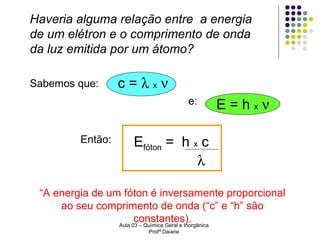
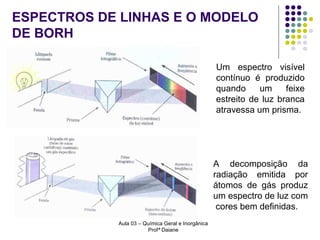
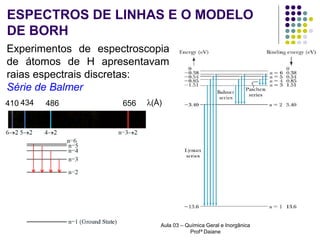
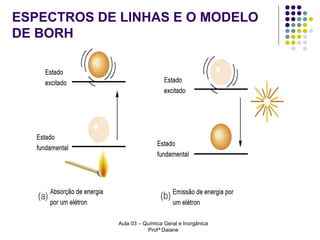
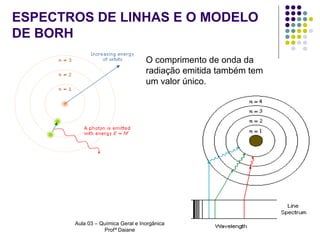
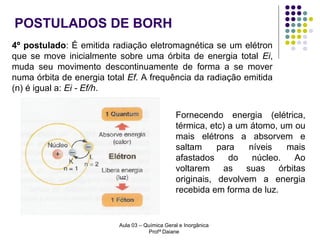
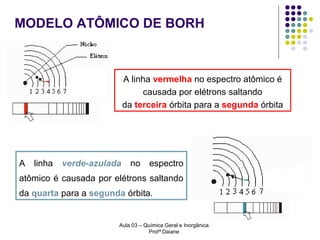
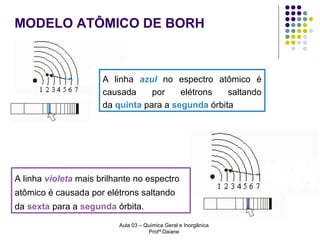
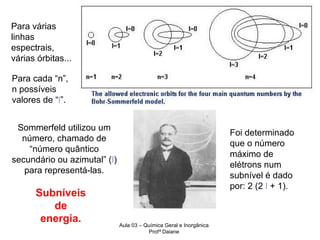
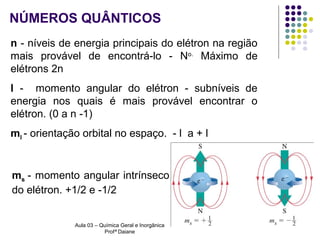
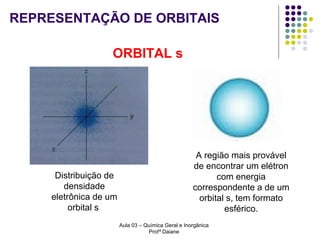
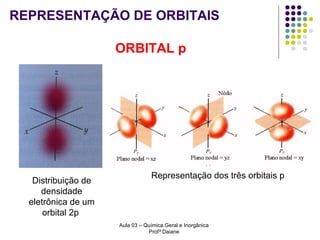
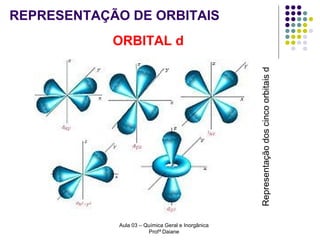
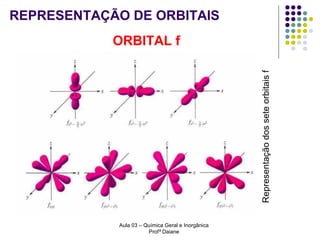
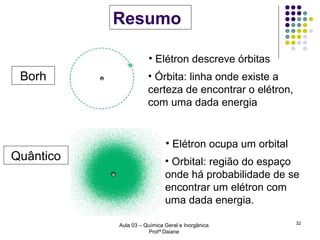
O documento descreve a evolução dos modelos atômicos, começando pelo modelo de Rutherford, passando pelo modelo de Bohr e chegando ao atual modelo quântico. O modelo de Rutherford propôs que a carga positiva e massa dos átomos estariam concentradas no núcleo, com os elétrons orbitando ao redor. O modelo de Bohr introduziu a quantização dos orbitais eletrônicos para explicar espectros de emissão. O atual modelo quântico vê os elétrons como partículas-ondas que