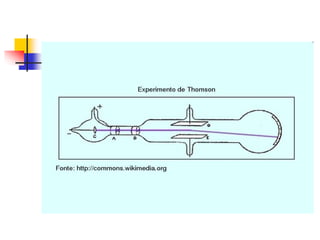
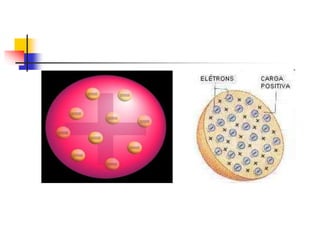
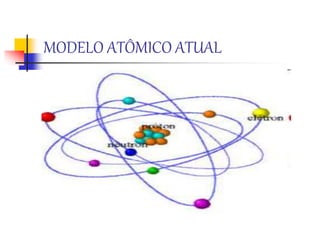
1) O documento descreve a evolução histórica da teoria atômica desde os filósofos gregos até os modelos atômicos modernos, passando por Dalton, Thomson, Rutherford, Bohr e outros.
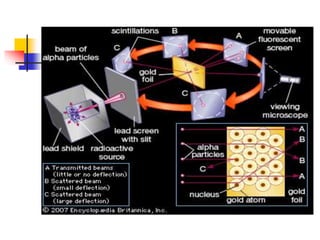
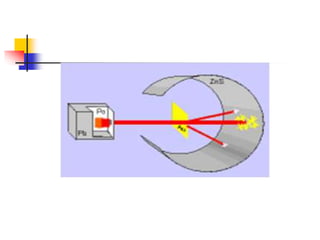
2) Rutherford propôs em 1911 que o átomo consiste de um núcleo denso rodeado por elétrons, com base em experimentos de bombardeio de partículas alfa.
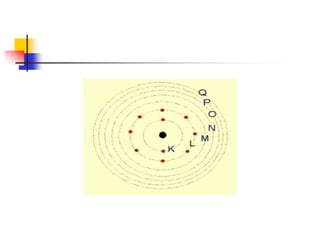
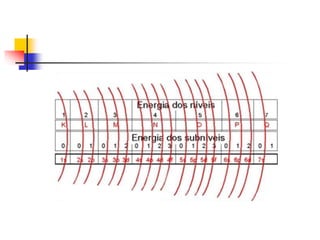
3) Bohr complementou em 1913 com a teoria dos quanta e postulou que os elétrons orbitam em níveis de energia dist