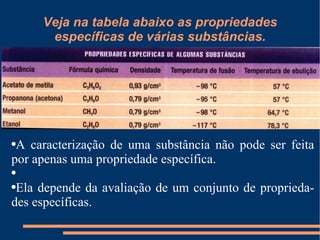
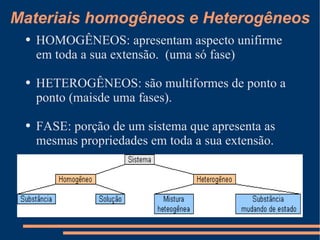
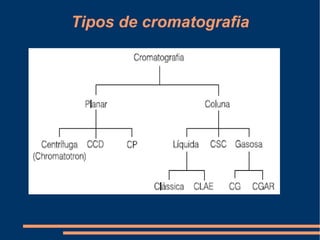
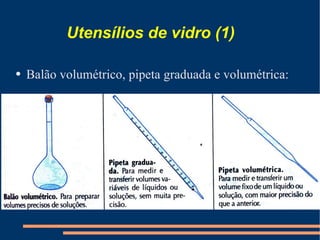
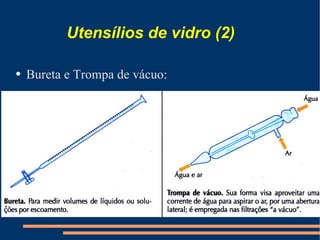
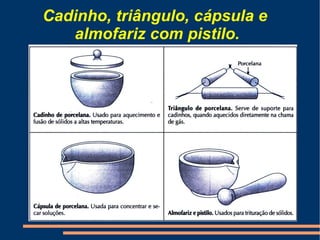
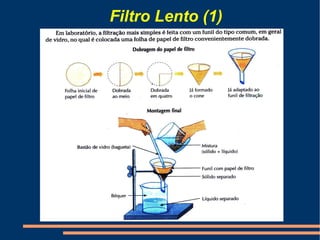
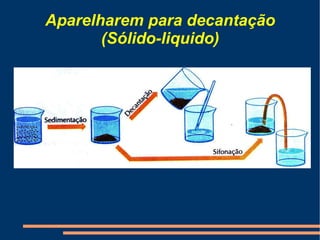
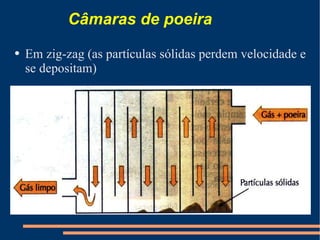
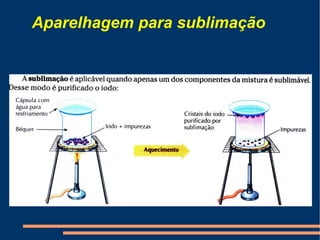
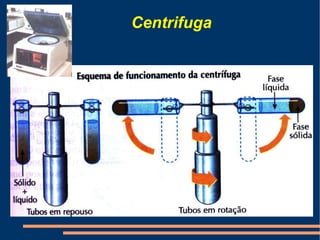
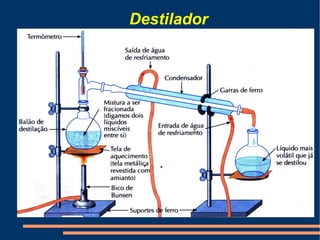
Este documento descreve vários métodos de separação de misturas, incluindo filtração, decantação, centrifugação, extração por solventes e destilação. Cada método é explicado e exemplos de suas aplicações são fornecidos. O documento também discute conceitos como pureza de substâncias e diferentes tipos de materiais.