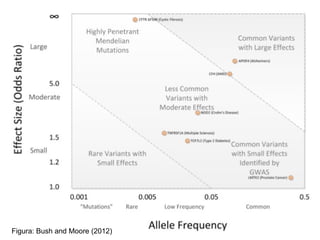
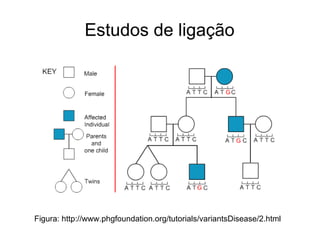
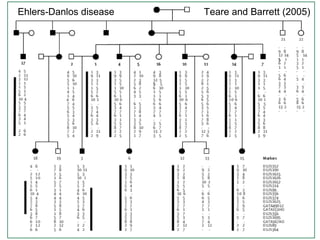
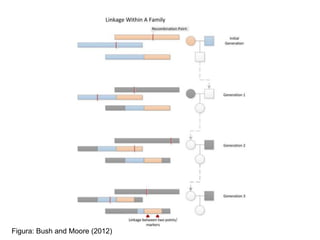
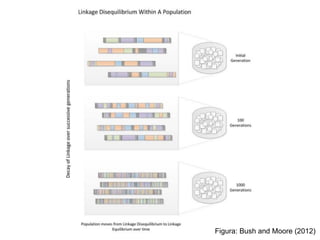
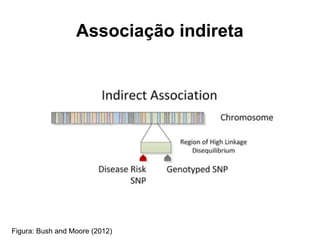
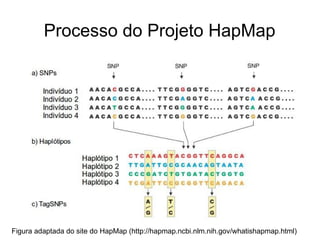
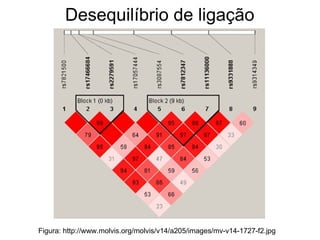
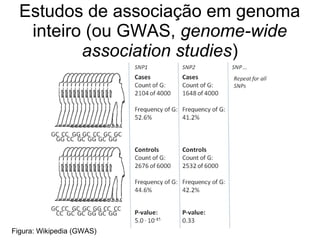
O documento discute estudos genéticos de doenças complexas, incluindo: (1) estudos de associação em todo o genoma que buscam variantes genéticas comuns associadas a doenças; (2) desafios como explicar apenas uma pequena parte da variação genética e incluir variantes raras; (3) o uso de interações proteína-proteína para entender melhor a arquitetura genética de doenças.