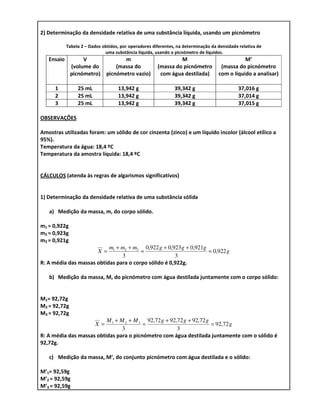
Este relatório descreve experimentos para determinar a densidade relativa de amostras sólida e líquida utilizando picnômetros. A amostra sólida foi zinco com densidade relativa medida de 7,092, com erro de 0,67%. A amostra líquida foi álcool etílico com densidade relativa medida de 0,908, com alto erro de 14,94%, possivelmente devido à impureza da amostra. Os resultados experimentais foram comparados com valores tabelados para identificar as amostras.