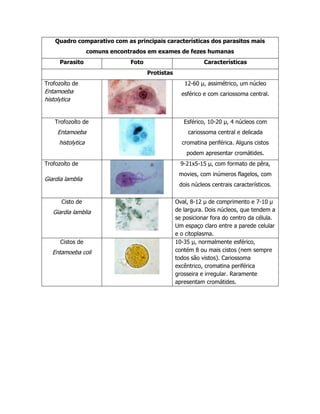
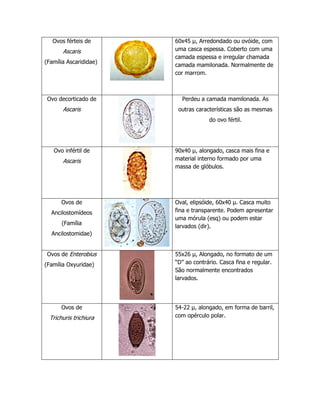
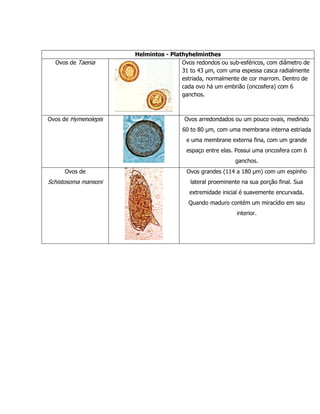
O documento descreve vários métodos para exame parasitológico de fezes, incluindo Hoffmann, Baermann & Moraes, direto, Kato e Stoll, Willis, MIF sedimentação, e teste da fita adesiva. Fornece detalhes sobre coleta de amostras, fixação, e procedimentos para cada método com o objetivo de detectar ovos, larvas e cistos de parasitas nas fezes.