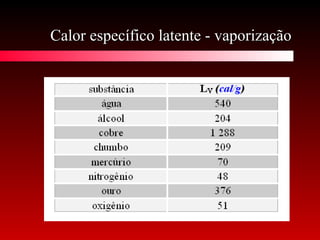
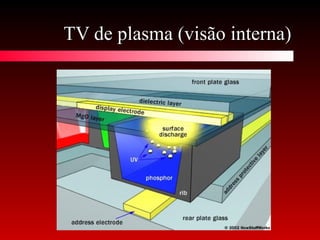
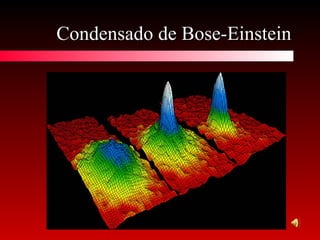
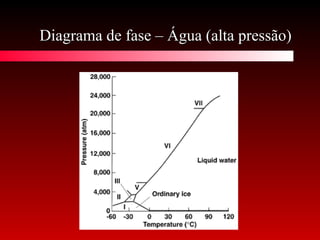
O documento discute conceitos de calorimetria, estados da matéria e diagramas de fase. Apresenta um breve histórico do conceito de calor, unidades de calor, efeitos térmicos, equações da calorimetria e estados clássicos e modernos da matéria. Explica conceitos como plasma, condensados de Bose-Einstein e Fermiônicos. Por fim, aborda diagramas de fase e suas variações com pressão.