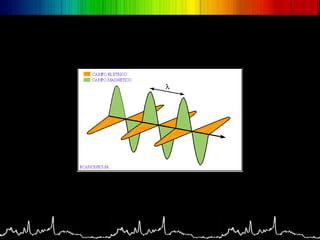
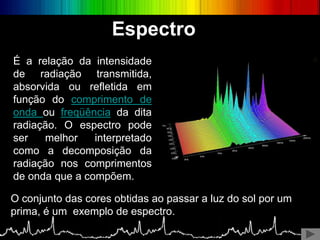
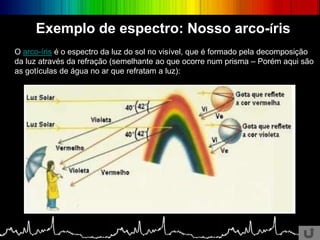
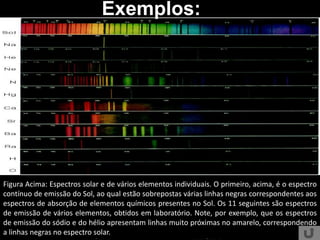
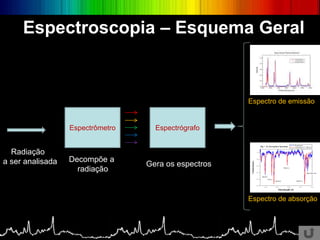
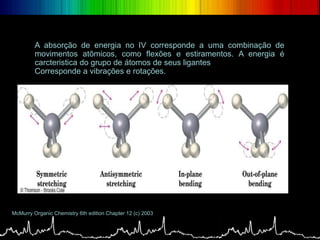
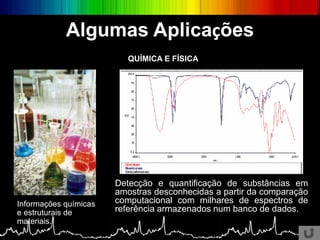
O documento discute os conceitos básicos da espectroscopia infravermelha. Aborda a descoberta do infravermelho, o funcionamento de espectrômetros e os principais tipos de espectroscopia. Também apresenta aplicações da espectroscopia em áreas como química, medicina, indústria e astronomia.