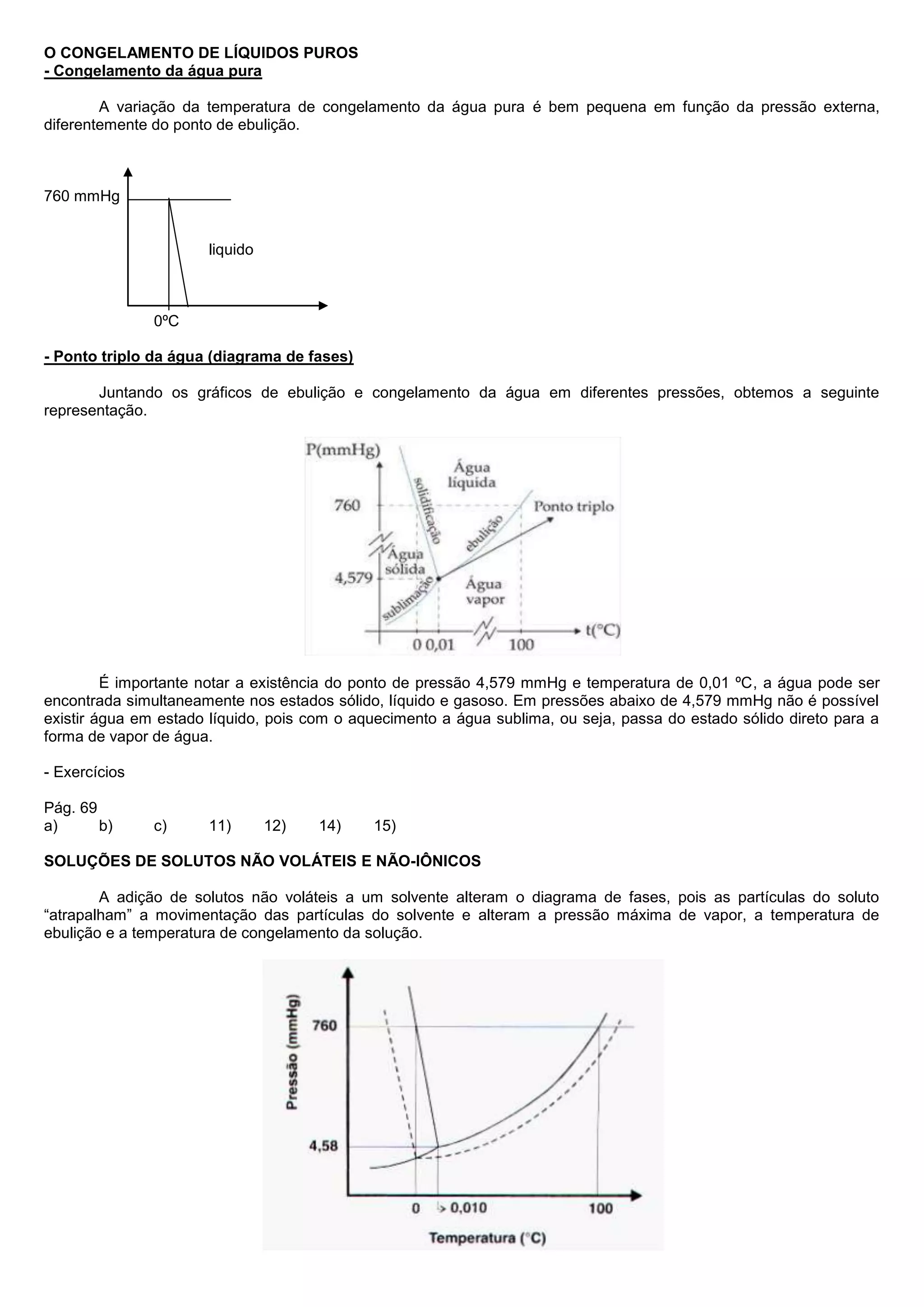
O documento discute os efeitos da adição de solutos não voláteis e não iônicos em um solvente. Adição de solutos causa abaixamento da pressão de vapor, aumento da temperatura de ebulição e diminuição da temperatura de congelamento do solvente de acordo com a Lei de Raoult. O documento também discute o ponto triplo da água e como a adição de solutos altera o diagrama de fases do solvente.