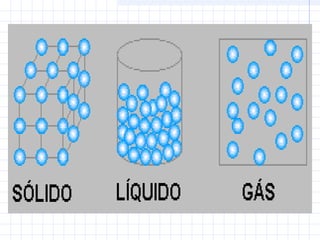
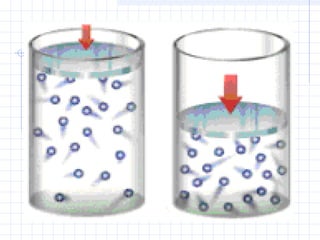
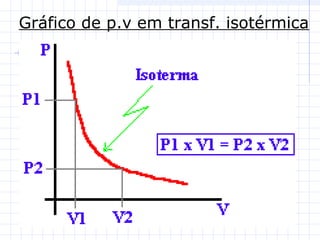
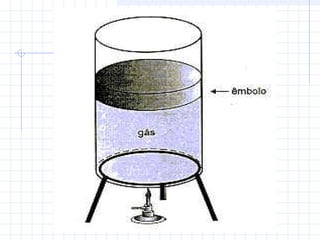
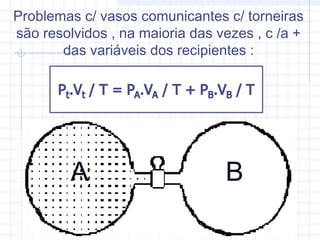
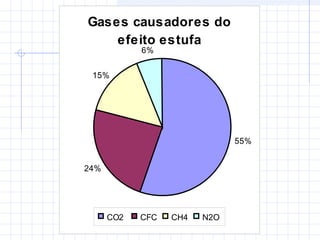
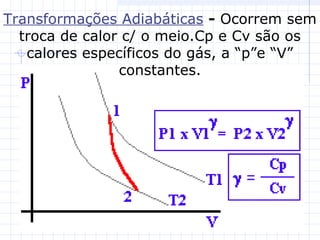
1) O documento discute as propriedades dos gases e suas transformações sob diferentes condições de pressão, temperatura e volume.
2) São descritas as leis de Boyle, Charles e Avogadro, assim como as transformações isotérmicas, isobáricas e isovolumétricas.
3) São apresentadas fórmulas para cálculo de pressão parcial, fração molar, volume parcial e densidade de gases em misturas.