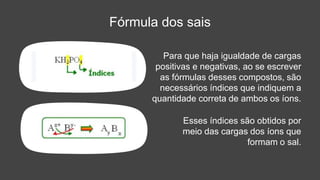
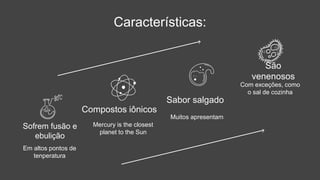
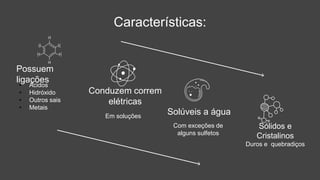
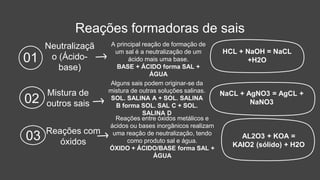
O documento descreve a definição e características dos sais inorgânicos, incluindo sua formação através da neutralização de ácidos e bases. Também apresenta a classificação dos sais em neutros, ácidos e básicos, além de discutir suas aplicações no cotidiano. A nomenclatura dos sais é detalhada, incluindo como derivá-los de seus ácidos correspondentes.




![Nomenclatura
Sufixo do
ácido
Sufixo do
ânion
formado
Número de
oxidação do
ânion (NOX)
-idríco -eto
NOX fixo e
negativo
hipo ...oso Hipo ...ito +1, +2
-oso -ito +3, +4
-ico -ato +5, +6
Per... -ico Per... -ato +7
Nome dos Sais Normais:
drico, oso, co por prefixos eto, to, ato
(nome do ânion do ácido) + sufixo eto/ito/ato de (nome do
cátion).
Ex. ácido clorídrico (HCl) + hidróxido de sódio (NaOH)
→ cloreto de sódio (NaCl) + água
Nome dos Sais Ácidos:
prefixos mono, di, tri, etc.
Sal = prefixo do nº de H+ + (nome do ânion) +
sufixo eto/ito/ato de (nome do cátion).
Ex. ácido sulfúrico (H2SO4) + hidróxido de sódio(NaOH)
→ monoidrogenosulfatode sódio (NaHSO4) + água
Sal = prefixo do nº de OH- + (nome do ânion) +
sufixo eto/ito/ato de (nome do cátion).
ácido clorídrico (HCl) + hidróxido de cálcio [Ca(OH)2]
→ monoidroxicloreto de cálcio [Ca(OH)Cl] + água](https://image.slidesharecdn.com/qumicaaa-221211104729-8962dbe4/85/QUIMICAAA-pptx-9-320.jpg)


