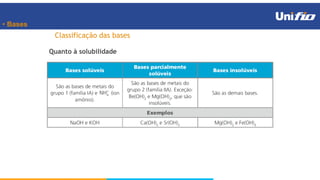
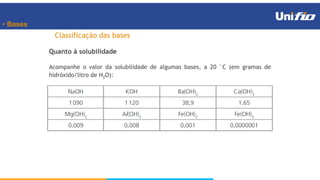
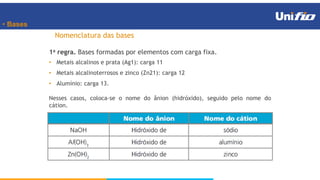
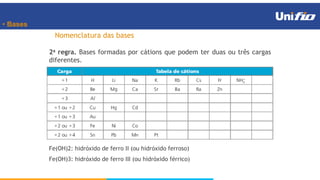
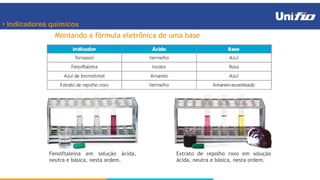
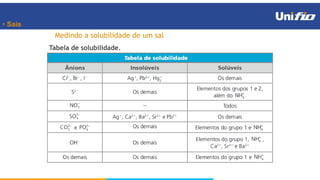
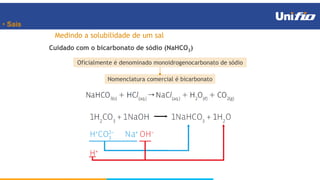
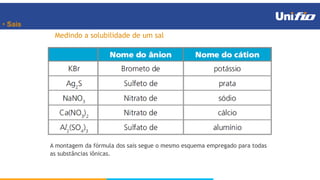
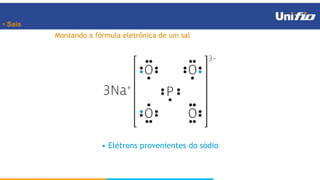
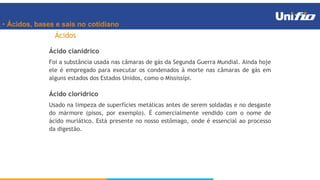
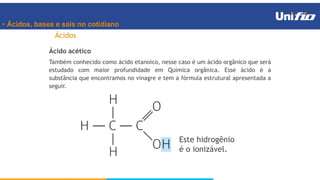
O documento apresenta os principais conceitos sobre funções inorgânicas, como ácidos, bases e sais. Aborda as propriedades e aplicações destas substâncias no cotidiano, incluindo exemplos de como são usadas em sabões, antiácidos, alimentos e construção civil. Também explica a nomenclatura, classificação e equações de dissociação de bases importantes.