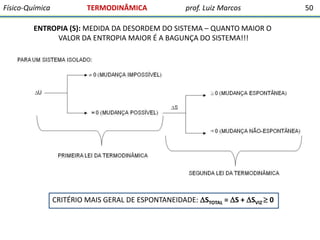
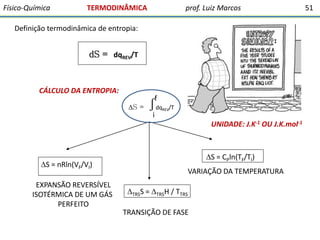
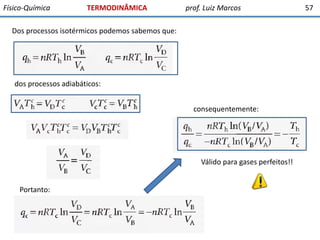
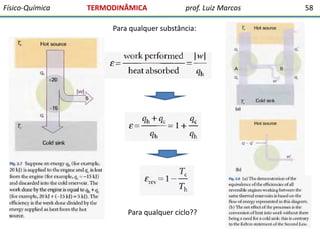
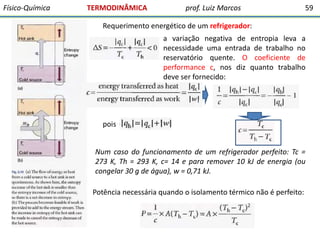
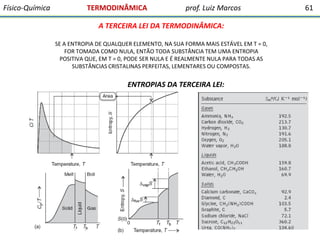
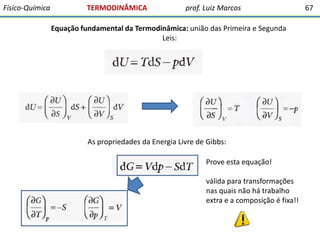
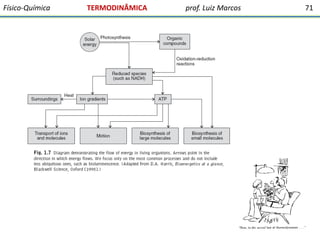
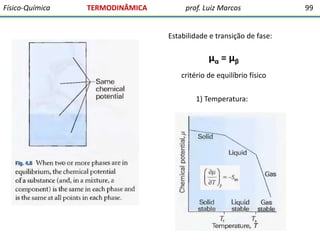
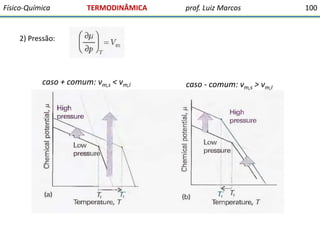
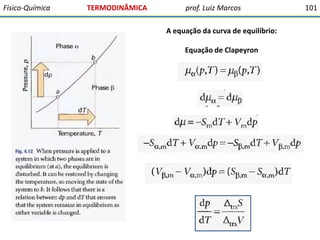
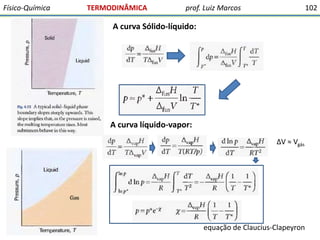
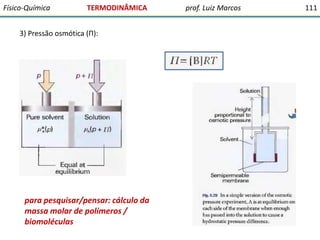
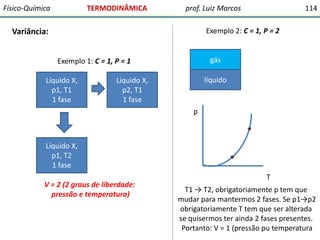
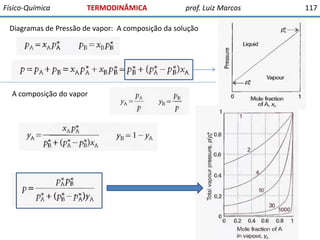
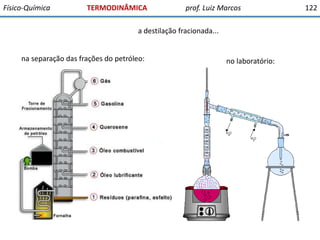
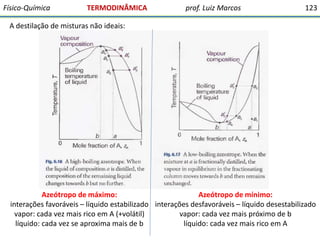
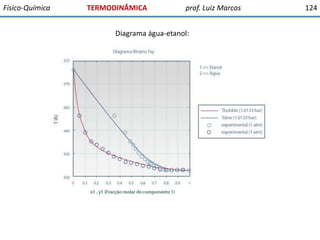
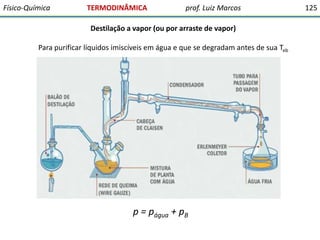
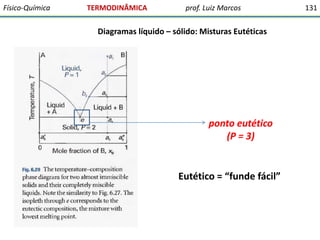
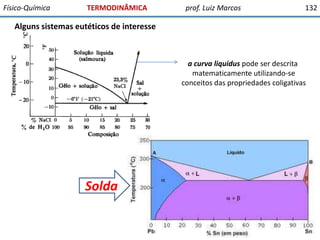
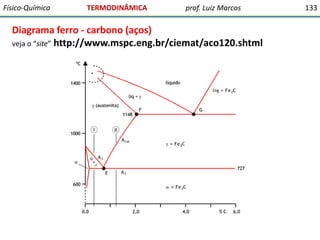
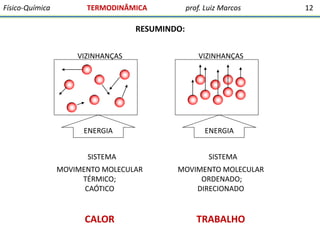
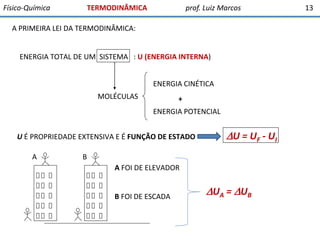
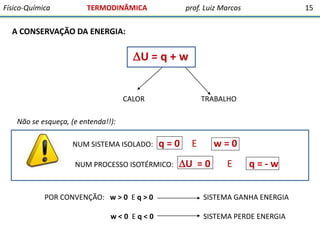
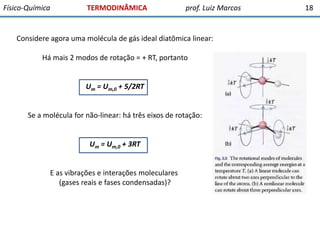
O documento discute conceitos fundamentais da termodinâmica. Em três frases:
1) A termodinâmica estuda as transformações de energia que levam à discussão quantitativa de fenômenos naturais e possibilitam antecipar outros.
2) O documento ressalta a importância dos químicos e farmacêuticos entenderem conceitos da termodinâmica e bioenergética.
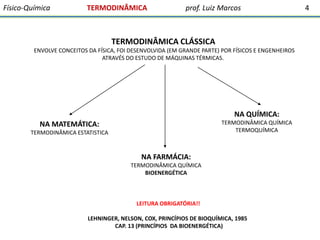
3) A termodinâmica clássica envolve conceitos da física desenvolvidos pelo estudo de máquinas











![Físico-Química
TERMODINÂMICA
prof. Luiz Marcos
25
Capacidade calorífica a volume constante:
Mais sobre capacidades caloríficas:
São propriedades extensivas:
[C] = J.K-1
Mas também podem ser expressas
de maneira intensiva:
[Cm] = J.(K.mol)-1 (molar)
ou
varia com T, mas para um pequeno ΔT, pode
ser considerada constante.
[c] = J.(K.g)-1 (específica)
cágua = 4 J.(K.g)-1](https://image.slidesharecdn.com/termodinamica1e2-140218080148-phpapp02/85/Termodinamica-1-e-2-25-320.jpg)