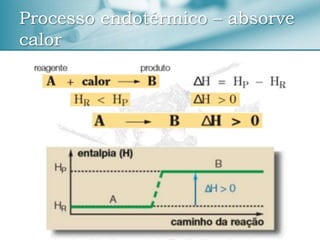
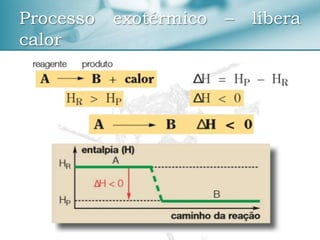
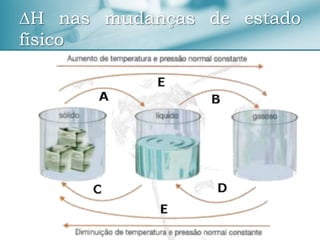
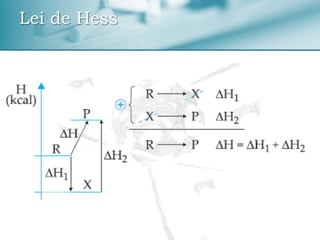
O documento discute conceitos de termoquímica como entalpia, processos exotérmicos e endotérmicos, e fatores que influenciam a variação de entalpia. Ele também apresenta exemplos de cálculos termoquímicos e equações com suas respectivas variações de entalpia.