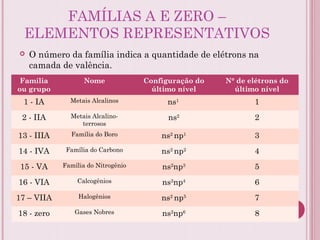
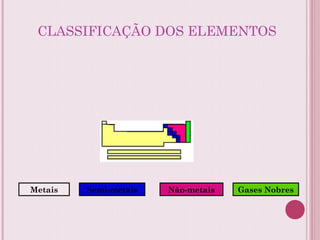
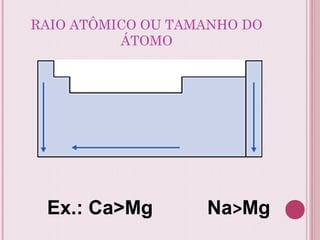
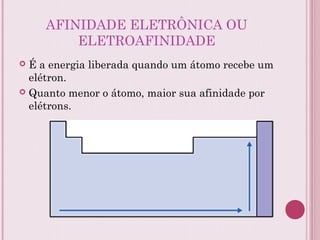
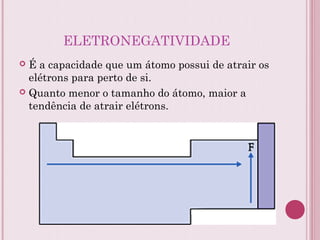
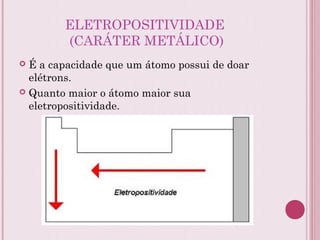
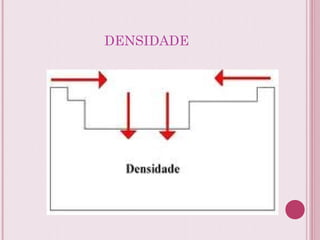
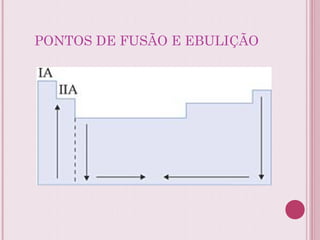
O documento resume a tabela periódica dos elementos, incluindo sua organização histórica por Mendeleev e Moseley e características atuais. Explica como os elementos são agrupados por número atômico e propriedades periódicas, e classificados em metais, não-metais, gases nobres e metais de transição.